A Survey on Robot Navigation Based on Mammalian Spatial Cognition
孟志林, 赵冬晔, 斯白露, 戴士杰. 基于哺乳动物空间认知机制的机器人导航综述[J]. 机器人, 2023, 45(4): 496-512.
MENG Zhilin, ZHAO Dongye, SI Bailu, DAI Shijie. A Survey on Robot Navigation Based on Mammalian Spatial Cognition[J]. ROBOT, 2023, 45(4): 496-512.
摘要:哺乳动物大脑的海马结构和内嗅皮层是产生空间认知的关键脑区,使动物具有在陌生环境中自主导航的能力。随着对自主智能导航系统的需求日益增长,发展受脑启发的机器人导航技术迫在眉睫。本文综述了哺乳动物空间认知的神经生理学机制,并在此基础上介绍了空间认知的计算模型及其在类脑机器人导航系统中的应用,最后讨论了类脑导航技术当前面临的问题及相关热点研究方向。
Abstract: Hippocampus and entorhinal cortex of mammalian brains are key brain regions involved in spatial cognition, enabling animals to autonomously navigate in unknown environments. With the increasing demand on autonomous and intelligent navigation systems, it is extremely urgent to develop brain-inspired robot navigation technologies. In this paper, the neurophysiological mechanisms of spatial cognition of mammals are reviewed, and computational models of spatial cognition and their applications to brain-like robot navigation systems are introduced. Finally, the challenges and future research directions of brain-like navigation technology are discussed.
Keywords: autonomous navigation brain-inspired navigation spatial cognition hippocampus entorhinal cortex
1 引言(Introduction)
导航是智能机器人系统的核心关键技术之一。在海洋勘探、防恐侦察、抗险救灾等任务中,机器人需要具备自主导航能力。比如在深海、地下矿井以及室内等环境中,由于卫星等通信信号不能有效传播,机器人无法稳定获得GPS等外源性位置信息。这些限制因素要求机器人能够不依赖于外源性位置信息自主地完成导航。机器人在环境中导航时需要回答“我在哪里”和“环境是什么样的”这两个基本问题。也就是说,机器人在环境中需要具有自定位(self localization)与地图构建(mapping)机制。从20世纪80年代以来,自定位和地图构建问题是机器人领域的热点前沿研究课题。一方面,在环境中确定自身位置需要地图信息。另一方面,构建环境的地图则需要确定位置才能把感知信息整合到地图的相应区域。自定位和地图构建问题互为对方的前提和输入。这种互相依存的关系决定了自定位和地图构建这两个问题必须一起解决。即移动机器人从未知环境中的某个位置出发,在移动过程中根据自身运动和传感器数据进行自定位,并增量式地构建环境的地图,称为同步定位与地图构建(SLAM)[1-2]。
SLAM方法可以大致分为基于滤波的方法、基于几何参数优化的方法和基于模型学习的方法。
基于滤波的SLAM方法主要包括扩展卡尔曼滤波、粒子滤波等概率建模方法,通过在线估计机器人位姿和地图的概率分布实现定位和地图构建[3-4]。机器人获得新的观测数据时,基于滤波的SLAM方法根据贝叶斯推断法则更新概率分布,因此需要在观测数据和地标之间进行匹配,即建立数据关联。错误的数据关联经常导致滤波器发散,造成基于滤波的SLAM方法在动态环境中鲁棒性不强。基于滤波的SLAM方法表征当前时刻机器人的位姿以及特征地图,特征之间的关联通过相关性矩阵表征。随环境尺寸的增大,基于滤波的SLAM方法的计算代价快速增加,可扩展性较差。
基于几何参数优化的SLAM方法表征机器人运动轨迹中的关键帧的位姿和特征的位置,通过匹配特征点和最小化匹配误差求解机器人的位姿和地图[5]。最具有代表性的方法是Mur-Artal等[6-8]构建的ORB-SLAM系统。ORB-SLAM系统使用ORB(oriented FAST and rotated BRIEF)特征描述子检测图像的特征,通过光束平差法求解机器人的位姿和特征地图。由于位姿和地图求解是在关键帧集合及其对应的特征上进行的,特征与关键帧之间建立的对应关系使求解的特征具有一致性,从而不需要维护特征的相关性矩阵,降低了计算复杂度[9]。
随着深度学习的兴起,基于模型学习的方法成为一种新的解决方案[10-14]。普林斯顿大学的邓嘉团队[13]构建了一个循环深度神经网络架构,优化光流预测的一致性,通过多帧循环迭代更新相机位姿和像素深度信息。基于模型学习的SLAM方法融合了几何参数优化方法对空间几何关系的约束和深度网络的端到端学习能力,提高了准确性和鲁棒性。深度学习网络还可以用于动态特征的识别和剔除,提升适应动态环境的能力[15-16]。基于模型学习的SLAM方法的缺点是训练模型需要的数据量很大,不利于动态实时调整模型。
随着社会的发展,人们对智能、长效、自适应的新型机器人导航系统的需求越来越迫切。智能机器人需要具备空间认知能力才能真正理解和适应动态复杂环境。英国伦敦大学的空间认知科学家Jeffery教授[17]认为先进导航系统应具有认知功能,也就是把导航过程中观测到的环境信息、事件时间序列进行整合,编码成表征空间关系的认知地图和空间记忆,从而支持记忆提取和规划推理。自然界中的动物往往不具备机器人导航系统中高精度的感知能力,却表现出惊人的空间学习和认知能力[18-20],能够跨越上千公里进行迁徙或者探索陌生环境,寻找食物并返回巢穴。脑科学对空间认知机制的一系列研究发现动物的大脑中存在天然的、自适应的生物导航系统[19, 21-22]。基于空间认知机制构建类脑导航系统对理解大脑的认知功能具有重要意义,同时也是提升现有导航系统的灵活性和鲁棒性的关键手段。脑是自然经过几亿年演化形成的通用智能系统。研究和发展类脑导航系统是揭秘脑的记忆原理及智能的产生机制的关键内容。2005年,《科学》杂志提出了125个重要科学难题[23]。在这125个重要科学难题中,与脑认知相关的有15个,记忆的存储与提取被列为25个亮点问题之一[24]。脑科学在微观、介观和宏观层次揭示认知的产生过程和机理,为信息科学从模型及算法的角度模拟和再现智能行为提供了依据。2008年,美国工程院宣布把脑的逆向工程作为21世纪人类面临的14个重大工程挑战之一[25]。2013年,欧盟和美国先后宣布启动“人脑计划”和“大脑活动图谱”计划。这两个计划将历时10~12年,预算均超过10亿美元,旨在通过实验发现人类脑部的连接和活动规律,通过超级计算机逐步构建模型,模拟人脑的功能。我国也于2021年启动了脑科学与类脑研究计划。脑科学和信息科学的深度交叉融合已经成为智能科学的研究范式,是构建未来全新体系结构的智能计算机和通用智能系统的方法论。解析和模拟空间认知神经环路的工作机制,发展能够适应非结构化、动态、广域环境的类脑导航系统,是理解智能的本质、发展新一代人工智能算法的重要问题[26]。
类脑导航是指受动物大脑空间认知神经机制启发的仿生导航技术。类脑导航技术在传统机器人导航技术中融入学习和记忆的神经计算机制,提高机器人导航系统的鲁棒性、自主性和环境自适应能力。其特点在于能够基于大脑空间导航机制表征智能体的空间方位、学习环境的认知地图、应对非结构化环境下的路径规划及任务决策等问题。类脑导航技术建立感知和记忆的多层级模块化网络模型,利用大脑的多感知信息整合、神经动力学、神经编码和突触可塑性等一系列机制来约束模型的结构和功能,使模型能够整合感知和运动信息,形成认知地图表征。类脑导航技术的优势主要表现为其具有空间关系的认知能力、定位的高效性和稳健性、对环境变化的适应性以及地图表征的可扩展性[27]。
传统机器人导航方法通常直接在感知空间构建地图,使用的地图表征形式包括点云地图、稠密特征地图等,与特征点的表观特征紧密耦合。由于缺乏从感知信息中形成概念和记忆的机制,传统的机器人定位和地图构建方法在大尺寸环境下需要消耗巨大的计算和存储资源,在动态环境中容易受到干扰。这些特点限制了传统机器人导航算法在大尺寸、非结构化、动态环境下的适应能力。类脑导航技术把感知信息映射到认知空间,建立环境的认知地图,表征感知信息隐含的空间结构,不受具体感知模态的约束。类脑导航技术模拟大脑神经环路的神经计算机制,网络模型通过循环连接以及兴奋与抑制的平衡产生稳定的放电模式,通过突触可塑性实现空间学习,与传统的机器人导航方法相比具有更高的鲁棒性和环境适应能力。类脑导航技术采用大脑空间记忆神经环路中多种神经细胞的编码模式,形成对大尺寸空间的多尺度高效编码,提升了导航系统的可扩展性。
本文聚焦类脑导航技术研究的最新进展,综述了以神经信息学、脑认知学为基础的类脑机器人导航技术研究体系。
2 哺乳动物大脑的空间认知机制(Spatial cognition mechanisms of mammalian brains)
哺乳动物能够自由地在自然环境中觅食、迁徙。这种优秀的导航能力来自于大脑对外界环境空间的认知和理解。脑科学的研究表明,哺乳动物能够在大脑内形成对外界空间的抽象表征,即环境的认知地图[28],并基于此完成导航任务。大脑的海马结构以及与其直接相连的内嗅皮层(EC)、下托复合体等脑区在认知地图构建、学习和记忆过程起到重要作用[19, 29],这些脑区一旦受损,动物的导航能力会受到明显影响[30]。海马结构与内嗅皮层、后下托等脑区存在广泛的连接和信息交互通道,形成了整合空间和非空间信息的大脑导航系统。
2.1 空间认知神经环路的信息传递通路
空间认知功能的实现是大脑多个脑区共同协作的结果。神经科学的研究逐步发现哺乳动物的空间记忆有内在的神经基础——海马结构和内嗅皮层等区域[31]。外界的剌激被感觉器官接收,经过感觉皮层和相关区域的多级编码和并行处理,最终到达海马结构,形成记忆。位于这个深度网络的最顶端,海马体和内嗅皮层清晰地分化成多个区域,具有高度结构化的连接结构,形成并行有序的神经环路。
海马结构位于内侧颞叶和丘脑之间,是感知-记忆-决策神经环路的重要节点[32]。海马结构包括齿状回(DG)、海马体(CA)和下托(Sub)。不同物种的海马结构具有相似的解剖结构,表明是进化过程中形成的稳定的神经结构。而海马结构在学习和记忆中的作用直到20世纪中叶随着对失忆病人H.M. 和位置细胞的研究才开始揭示。
感觉皮层传来的感知觉信息和前额叶皮层的决策相关的信息汇聚到前下托等海马旁区域,并向内嗅皮层传递,经过内嗅皮层的进一步整合在海马体中形成陈述性记忆。记忆表征通过记忆的固化过程转移到联合皮层区域形成长期记忆。海马旁区和海马结构之间通过内嗅皮层形成多条并行的信息传递通路,比如嗅周皮层与嗅后皮层分别映射到外侧内嗅皮层(LEC)和内侧内嗅皮层(MEC)。位于内嗅皮层不同层的神经元与海马结构的不同子区相连接,各个层级并行工作(图 1)。
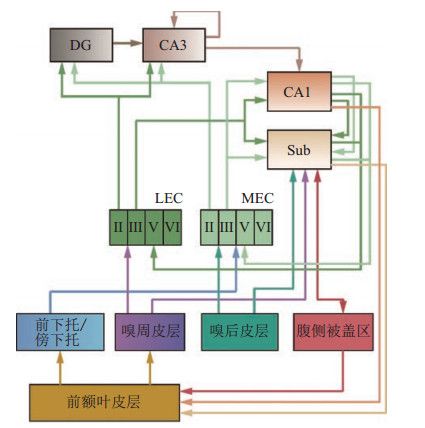 图 1 哺乳动物大脑导航系统示意图 Fig.1 Navigation system in the mammalian brain
图 1 哺乳动物大脑导航系统示意图 Fig.1 Navigation system in the mammalian brain 内嗅皮层是海马体和皮层之间交换信息的枢纽。内嗅皮层分成内侧内嗅皮层和外侧内嗅皮层2个部分。MEC神经元编码世界坐标系下的空间信息;而LEC神经元编码时间信息和自我中心坐标系下的场景信息。内嗅皮层第2层中的神经元发出连接到达齿状回和CA3区域的神经元,分别与靠近胞体的近端和远端的树突相连。齿状回是大脑中新细胞生发的2个区域之一。它的功能是模式分离,通过把来自内嗅皮层的输入进行正交化,让新的输入模式和已经熟悉的模式区分开来,从而减少记忆之间的干扰。齿状回通过苔藓纤维向CA3区锥体神经元投射。CA3区域的神经元通过侧向连接相互连接,形成联想记忆的存储体。CA3区域根据齿状回和内嗅皮层传来的输入完成新记忆的存储或者旧记忆的提取。CA3区的神经元进一步向CA1区单向投射。CA1区是海马结构的输出区域。CA1区整合CA3区和EC传来的信息,在空间学习中发挥重要的作用。MEC和LEC第3层中的神经元投向CA1区的连接模式具有差异性。MEC神经元非选择性地与CA1区的所有锥体细胞相连,而LEC则选择性地与CA1区域的部分锥体细胞形成单突触连接[33]。CA1区把海马体存储的记忆表征进一步传递到下托和内嗅皮层第5层,从而形成海马体和内嗅皮层之间的神经回路。通过CA1和下托,海马结构也向前额叶皮层和腹侧被盖区传递信息。海马体和腹侧被盖区之间的记忆功能回路利用多巴胺等信号来控制信息进入海马体的记忆存储[34]。海马体和多个脑区之间的信息交互通路共同构成了空间导航神经环路。
综上所述,海马体和内嗅皮层位于哺乳动物大脑神经信息处理通路的关键节点[35]。大脑接收到的外界感知信息,如运动、视觉等信息,首先经过感知觉皮层的多级处理后到达内嗅皮层并进一步向齿状回、海马体、下托传递。海马结构整合多种时空信息,形成认知地图。海马体存储的记忆信息又返回到内嗅皮层。内嗅皮层进一步将接收到的编码信息投射至海马体周围神经皮层。内嗅皮层在大脑空间导航神经环路中起到了关键作用,感知信息通过内嗅皮层完成由大脑皮层向海马体的传递[36],实现了对空间感知信息的处理、编码和解码等一系列功能[37]。
2.2 海马体神经元
O'Keefe等[19, 38-39]发现位于大脑海马体中的位置细胞是动物大脑构建认知地图的基础。他们通过对大鼠的在体神经电生理记录实验发现,当大鼠运动到实验环境中的某个位置(比如图 2(a)中方形环境的右上角)时,海马体中对这一位置敏感的位置细胞就会激活并放电。这个放电区域称为位置细胞的位置野[38]。在位置野的中心,位置细胞的放电频率达到峰值;随着动物的运动,位置细胞的放电频率发生变化;当动物离开位置野时,位置细胞的放电恢复到很低的基线水平。每个位置细胞的位置野互不相同。除了老鼠等啮齿类动物,在蝙蝠、鸟类、灵长类等动物的大脑中也发现了位置细胞。动物通过大量的位置细胞构成的群体放电向量实现对自身位置的编码,进而生成表征空间关系的认知地图。位置细胞的位置野只编码环境中的位置信息,并不编码环境的感知信息。位置细胞的位置野相互独立,与位置细胞在解剖学中的位置无关[40]。当动物处于较小的2维空间中时,其位置细胞通常只有单个位置野。处于大尺度空间时,位置细胞的位置野的平均数量会增加,服从伽马泊松分布[41]。纯位置细胞不编码方向信息[39],因此,无论动物的头朝向如何变化,其位置细胞都会保持稳定的放电模式。在狭长的线性空间中,位置细胞的放电在方向上会表现出选择性,说明位置细胞的空间编码具有灵活性。屏状核等脑区存在联合编码头朝向和位置的细胞[42],表明在海马体形成位置信息编码之前,其他脑区也能参与位置信息的编码。
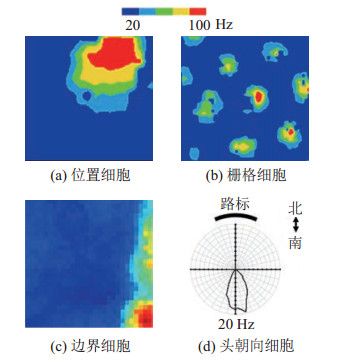 图 2 哺乳动物脑内导航神经元的放电活动图[35] Fig.2 Firing activities of navigational neurons in the mammalian brain
图 2 哺乳动物脑内导航神经元的放电活动图[35] Fig.2 Firing activities of navigational neurons in the mammalian brain 位置细胞可以随着环境的变化而调整其放电野,从而能编码不同环境的空间位置。海马体自适应地招募神经元群体从而编码不同环境的能力称为编码重构(remapping)[22, 43]。编码重构分为全局重构(global remapping)和频率重构(rate remapping)。全局重构是指位置细胞的放电野发生变化,包括位置和大小等;频率重构时位置细胞的放电野不变,但是放电频率发生变化。位置细胞的位置野通常在外界环境产生细微变化时[44-45],如地标的颜色或形状变化时,产生频率重构。而当动物所处的环境产生剧烈变化时,如进入新的环境空间中,其所接收的视觉和感觉信息都产生了剧烈变化,此时,海马体中的位置细胞往往产生全局重构现象[22],其放电野的空间位置产生变化,并且与处在原环境中时放电野的位置不同。
位置细胞整合外界的视觉等感知觉信息和来自栅格细胞的空间信息[46-47]。一方面,位置细胞可以根据环境中地标的视觉信息形成记忆,当再次遇到相同的地标时,特定的位置细胞激活,并通过表征地标之间的空间关系实现对环境位置的编码[48]。另一方面,位置细胞同样接收来自内嗅皮层中的栅格细胞投射的轨迹推算信息。当动物自由运动时,栅格细胞能够对前庭系统的运动信息进行整合,通过对运动速度和方向的积分来表征环境中不同位置之间的距离和方向信息,并传递给位置细胞进行编码,从而实现对环境空间结构的表征。位置细胞通过对感知信息和运动信息的整合将时间信息和空间信息进行关联,这种信息处理机制被认为是海马体产生空间记忆的基础[49]。
2.3 MEC神经元
内嗅皮层位于颞叶并与海马体相邻。MEC包含多种类型的神经元,对世界中心坐标系下的自身方位表征发挥了重要作用。内侧内嗅皮层中大量存在着栅格细胞[21]。栅格细胞接收来自前庭的速度和方向等自身运动信息、来自嗅后皮层等区域的感知信息以及海马体反馈的位置信息,并通过路径积分和学习机制使大脑建立当前自身位置在世界坐标系中的多尺度位置编码。当大鼠在2维平面环境中进行探索时,栅格细胞在多个区域产生稳定的放电野。栅格细胞的多个放电野形成六边形栅格状的周期性排布(图 2(b)),每个放电野位于六边形栅格的顶点,因此被命名为栅格细胞[21]。MEC栅格细胞的周期性空间放电模式可以用放电野之间的间距λ" role="presentation">λ、放电野的空间相位φ" role="presentation">φ和栅格对称轴的方向ω" role="presentation">ω来描述(图 3)。
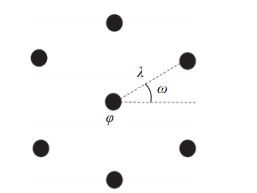 图 3 栅格细胞的放电野可以由三角栅格的3个主要参数描述 Fig.3 3 main parameters of triangular grid to describe the firing fields of a grid cell
图 3 栅格细胞的放电野可以由三角栅格的3个主要参数描述 Fig.3 3 main parameters of triangular grid to describe the firing fields of a grid cell 在解剖学结构上,位于皮层相邻位置的栅格细胞形成的栅格的方向和间距往往相同,但是六边形栅格顶点位置一般不同,即具有相位差。沿皮层的背侧腹侧轴,栅格细胞呈模块化分布。不同的模块内栅格细胞具有不同的间距和方向[50]。位于腹侧的栅格细胞具有更大的放电野和放电野间距,不同模块的栅格细胞的尺度按等比数列从背侧向腹侧逐步增大。目前,受记录手段的限制,栅格间距的尺度范围还未测定。Hafting等[21]的电生理实验在MEC背侧记录到的神经元的栅格间距变化范围为39~73 cm。后续研究表明位于腹侧区域的栅格细胞的栅格间距可以达到3 m[51]。总之,具有多尺度栅格放电野的栅格细胞通过群体编码实现对空间信息的多尺度表征。
从皮层的分层结构上看,内嗅皮层表现为多层级结构,各层神经元的种类和特性存在差异。其中,栅格细胞普遍存在于内嗅皮层的第2、3、5和6层,但是位于不同层级的栅格细胞其细胞特性不同。其中第2层中的栅格细胞为纯栅格细胞[52],其放电频率与空间位置相关,和动物的头朝向没有全局一致的关系。而在内嗅皮层的较深层,如第3和第5层,除了存在少量的纯栅格细胞,同时还存在着大量表征栅格信息和头朝向信息的联合栅格细胞[53]。联合栅格细胞对动物的头朝向敏感,只在当动物以其敏感的方向通过六边形栅格顶点时,联合栅格细胞才会激活放电。
栅格细胞形成栅格状位置表征不依赖视觉信息的输入。实验表明,大鼠在黑暗的实验环境中运动时,栅格细胞依然形成稳定的放电野[21]。然而,视觉信息会影响六边形栅格表征顶点的旋转对齐。如果将大鼠放在圆柱形实验环境中自由运动,旋转位于圆柱墙壁上的提示卡后,栅格细胞的栅格状放电图也会随之旋转同样的角度[21]。因此,栅格细胞形成稳定放电野的过程是由网络内在机制决定的,但是视觉信息帮助栅格细胞把神经编码锚定在环境中显著的地标特征上。
MEC中有少量的细胞编码环境的边界,称为边界细胞[54]。边界细胞的放电野沿着环境的边界形成。有的边界细胞只编码某个方向的边界(图 2(c)),有的边界细胞对多个边界有响应。边界细胞可能用于纠正导航中的航位推算误差。
MEC的第3层和更深的分层中还有大量的编码动物头的方向的头朝向细胞[53]。头朝向细胞的放电表现出方向选择性,只有当动物的头指向细胞偏好的某个特定方向时很活跃(图 2(d)),起到指南针的作用。头朝向细胞会选择环境中显著的地标作为参照。不同的头朝向细胞偏好的方向保持相对固定,它们之间的相对方向不随环境的变化而改变。
海马体和内嗅皮层中的神经元对导航中的多种空间信息进行编码,构成一个完整的导航体系。其中位置细胞和栅格细胞提供互补的空间位置编码(图 4)。位置细胞的空间编码是稀疏编码,在环境中只有少数的位置细胞同时放电,每个位置细胞只有少数几个放电野。栅格细胞的空间编码是非稀疏的,在2维旷场环境中每个栅格细胞具有多个按周期性三角栅格排布的位置野。进入不同的环境中,位置细胞和栅格细胞都发生全局重构。海马结构随机选择不同的位置细胞编码新的环境,位置细胞的位置野之间的位置关系在不同的环境中会打乱重新分布。栅格编码会随着环境的变化而发生整体的旋转和平移,这表明栅格细胞能够通过保持固定的空间相位关系来表征环境的距离测度[22, 55]。
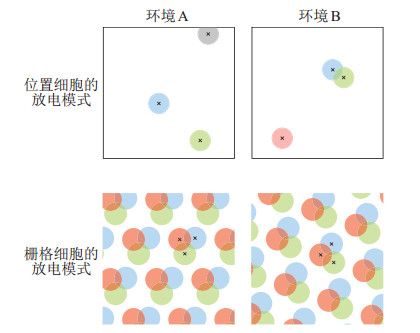 图 4 海马体中的位置细胞和内嗅皮层中的栅格细胞提供不同特性的空间编码 Fig.4 The spatial codes of place cells in hippocampus and grid cells in entorhinal cortex have different characteristics
图 4 海马体中的位置细胞和内嗅皮层中的栅格细胞提供不同特性的空间编码 Fig.4 The spatial codes of place cells in hippocampus and grid cells in entorhinal cortex have different characteristics 2.4 LEC神经元
与MEC神经元支持动物的多尺度空间表征不同,现有的实验证据表明LEC神经元能够表征场景中的物体信息、自我中心坐标系下的方向以及时间等多种信息[56-59]。当环境中存在物体时,一部分LEC神经元在物体周围形成放电野[57],称为物体细胞(图 5(a))。移除物体后,这些物体细胞的放电野随之消失。有的LEC神经元对物体记忆进行编码,称为物体迹细胞。它们在物体消失后产生放电野,指示曾经出现过的物体的位置(图 5(a))。王成等[58]的研究发现,有些LEC神经元能够对环境的边界、物体以及目标位置在自我中心坐标系的方向进行编码(图 5(b))。这些自我中心方向细胞能够支持动物完成自我中心导航。时间的表征是动物实现环境探索、导航任务的关键组成部分,对任务过程中情景的时间表征不需要保证绝对精确,能够记录事件的相对发生顺序即可。Tsao等[59]研究发现外侧内嗅皮层中存在对时间的抽象表征,该表征可以支持导航任务中的情景记忆功能。
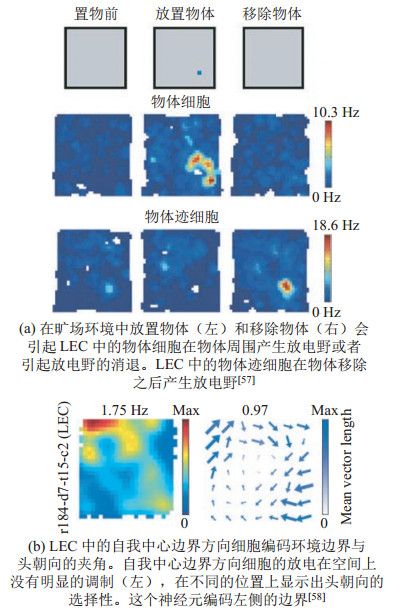 图 5 外侧内嗅皮层神经元编码物体和在自我中心坐标系下的边界方向 Fig.5 Some neurons in lateral entorhinal cortex encode objects and bearings of boundary in egocentric frame
图 5 外侧内嗅皮层神经元编码物体和在自我中心坐标系下的边界方向 Fig.5 Some neurons in lateral entorhinal cortex encode objects and bearings of boundary in egocentric frame 综上,内嗅皮层的2个脑区流入海马体的信息流存在根本的区别,外侧内嗅皮层神经元主要负责对物体信息、自我中心坐标系下空间信息和时间等信息的处理,而内侧内嗅皮层主要负责世界坐标系下空间信息的处理[60]。
3 空间认知的理论模型(Theoretical models of spatial cognition)
海马结构和内嗅皮层是形成认知地图的核心脑区。环境中的感知信息经感觉皮层和相关区域的加工通过内嗅皮层到达海马体。海马体-内嗅皮层神经环路是如何形成环境的认知地图的?这是解析空间记忆神经环路的重要问题,对构建有环境理解力的类脑智能算法具有重要的理论意义。很多理论模型尝试解释这一环路中不同神经元表征空间位置关系的计算原理。
3.1 位置细胞模型
根据海马结构中不同区域的连接结构,位置细胞的计算模型分为竞争学习网络模型和吸引子网络模型。齿状回和CA1中的神经元之间没有直接的兴奋性循环连接,它们和内嗅皮层之间的网络可以用竞争学习网络来建模[61-63]。齿状回和CA1位置细胞的放电频率的变化可以描述为
τr˙t=−rt+f(Wtgt−κ|rt−1|+c)" role="presentation">τr˙t=−rt+f(Wtgt−κ|rt−1|+c) (1)其中τ" role="presentation">τ是神经元放电的时间常数,r" role="presentation">r是位置细胞群体的放电向量,f(⋅)" role="presentation">f(⋅)是神经元放电的激活函数,g" role="presentation">g是MEC栅格细胞群体的放电向量。W" role="presentation">W是栅格细胞到位置细胞的连接矩阵。|⋅|" role="presentation">|⋅|代表求L1范数运算。κ" role="presentation">κ是细胞间的抑制强度。c" role="presentation">c是来自LEC等脑区的输入向量。连接矩阵通过赫布型学习规则进行调整:
其中τs" role="presentation">τs是突触学习的时间常数。通过学习,齿状回和CA1中的神经元把内嗅皮层的放电模式转换为稀疏编码。
CA3中的神经元具有丰富的兴奋性循环连接,它们的放电状态形成吸引子,能稳定地表征记忆。根据CA3神经元之间的兴奋性连接结构,吸引子神经网络采用结构化的循环连接对神经元感受野之间的位置关系进行编码,能够在神经动力学的驱动下产生类似CA3位置细胞的放电模式[64]。CA3位置细胞的放电频率的变化可以描述为
其中K" role="presentation">K是位置细胞之间的连接矩阵,通常具有对称性和平移不变性。
3.2 栅格细胞模型
栅格细胞的计算模型大致分为3类[65-66]。振荡相干模型把栅格细胞的放电频率建模为多个相干模式的乘积
rt=f(∏i=1n[o(ωs+ρvtcos⁡(ϕt−ϕi),φi)+o(ωs,0)])o(ω,φ)=cos⁡(ωt+φ)" role="presentation">rt=f(∏i=1n[o(ωs+ρvtcos(ϕt−ϕi),φi)+o(ωs,0)])o(ω,φ)=cos(ωt+φ) (4)其中o(ω,φ)" role="presentation">o(ω,φ)是初始相位为φ" role="presentation">φ、频率为ω" role="presentation">ω的振荡函数。ωs" role="presentation">ωs是胞体处的振荡频率,由局部场电位的θ" role="presentation">θ振荡频率决定。vt" role="presentation">vt是运动速率。ρ" role="presentation">ρ是一个正的参数,决定栅格的间距。ϕt" role="presentation">ϕt是运动的方向。ϕi" role="presentation">ϕi是树突上第i" role="presentation">i个振荡输入所偏好的运动方向。每个相干模式是由神经元胞体处的基线振荡输入和树突的受速度调控的振荡输入之间的干涉而产生的。受速度调控的振荡累积它所偏好方向上的速度分量。当振荡输入偏好的方向相差60∘" role="presentation">∘的整数倍时,细胞产生三角栅格状的空间放电野[67-72]。
与振荡相干模型的单细胞级别的机制不同,连续吸引子网络模型使用结构化的循环连接在网络层次产生群体放电[73-79]。群体放电状态的变化描述为
τr˙t=−rt+f(Jrt+I(vt))" role="presentation">τr˙t=−rt+f(Jrt+I(vt)) (5)其中J" role="presentation">J是栅格细胞之间的连接矩阵,通常具有不对称性。I(vt)" role="presentation">I(vt)是与速度向量vt" role="presentation">vt相关的输入。在速度输入的驱动下,连续吸引子网络能够连续地更新放电状态,与动物的空间位置保持对应关系。
自适应模型产生栅格放电模式的2种机制是单细胞层次的放电频率自适应和网络层次的竞争学习[80-84]。
栅格细胞的放电频率向量r" role="presentation">r由神经元的激活状态通过激活函数f" role="presentation">f决定:
rt=f(αt)τaα˙t=−αt+ht−βtτiβ˙t=−βt+htht=Utp+Jtrt" role="presentation">rt=f(αt)τaα˙t=−αt+ht−βtτiβ˙t=−βt+htht=Utp+Jtrt (6)其中αt" role="presentation">αt为栅格细胞的激活状态,编码神经元放电的强弱。ht" role="presentation">ht为栅格细胞的输入电流。βt" role="presentation">βt为适应电流,代表过去一段时间内的输入平均值。τa" role="presentation">τa和τi" role="presentation">τi是时间常数。p" role="presentation">p是位置细胞的群体放电向量。Ut" role="presentation">Ut是位置细胞到栅格细胞的前馈连接矩阵,Jt" role="presentation">Jt是栅格细胞之间的连接矩阵。Ut" role="presentation">Ut和Jt" role="presentation">Jt都通过赫布型学习规则进行调整。
由于其学习机制,自适应模型能够在不同几何特征的环境中产生三角栅格编码[85-88]。
3.3 感知记忆神经环路模型
在复杂环境中导航,大脑需要将视觉信息和自身运动信息进行融合,建立环境的认知地图表征。大脑的这种信息融合处理机制离不开感知觉皮层、内嗅皮层和海马体等多脑区的协同。MEC神经元整合从感知觉系统传来的感知信息和运动信息,形成编码世界坐标信息的神经元发放模式;LEC神经元则更多地编码非空间信息或者自我中心坐标信息,如关于环境中地标的视觉信息或者边界相对于自身的方向等。海马体神经元把内嗅皮层编码的多种信息进一步融合,在奖赏信号的调控下形成空间记忆[47-49]。已有一些工作建立了感知记忆神经环路模型,探讨多脑区协同完成导航任务的机制。
感知记忆神经环路模型可以分为监督学习模型和无监督学习模型。
基于监督学习的感知记忆神经环路模型通过预测智能体的位置或头部方向来训练网络中的连接矩阵[89-90]。Cueva等[89]提出了一个循环神经网络模型,对运动信息进行积分并预测空间位置。模型以真实的位置信息作为监督信号优化网络的连接权重,并用连接向量的长度以及神经元放电的能量作为监督学习的正则化约束。经过学习,网络产生了多种细胞类型,包括栅格细胞、位置细胞和边界细胞。尽管基于监督学习的感知记忆神经环路模型没有考虑太多神经科学的约束,但它们从优化的角度说明栅格细胞等表征空间信息的神经元的活动是一种具有最优性的编码。许铁等[90]进一步分析了循环神经网络的动力学特性,发现网络在不同的学习目标下产生不同类型的吸引子。预测位置能够使网络形成连续吸引子,有利于完成基于路径积分的导航任务。预测地标能够使网络产生离散的吸引子,有利于完成基于地标的导航任务。他们提出了一种模块化的循环神经网络模型,把预训练好的2种循环神经网络组合在一起,在强化学习的驱动下灵活地实现不同导航方式之间的切换。
基于无监督学习的感知记忆神经环路模型更多地从生物可行性的角度出发,基于感知记忆神经环路的连接图谱建立网络模型,并采用赫布型学习等方法调整脑区之间的连接矩阵,促使海马神经元的放电与输入空间的典型特征进行关联,形成稀疏编码。Burgess等[91]构建了一个基于视觉输入的多脑区前馈神经网络模型,并在微型移动机器人上验证了模型的导航功能。这一模型利用相机和红外传感器检测并估计边界的距离和方向。边界信息经过感知神经元的表征提供给内嗅皮层,海马体的位置细胞在内嗅皮层的输入下通过竞争学习形成位置野。该模型完全依赖于外界环境空间中的视觉感知信息,在黑暗等没有视觉信息输入的环境中无法生成稳定的空间表征。Samsonovich等[73]则从网络内在的神经动力学机制出发提出了基于连续吸引子网络的路径积分模型。该模型设计了局部的兴奋性循环连接,形成表征方向和位置的放电峰,利用不对称的连接结构驱使放电峰的中心在相应的方向移动,从而跟踪智能体的位姿。通过建立吸引子网络和感知神经元之间的关联,网络可以减小和修正跟踪误差。该模型在仿真环境中能形成类似位置细胞的空间放电模式。由于该模型的循环连接只考虑了运动的方向,没有考虑运动速率的变化,因此为了使放电峰的移动速度与智能体的真实速度匹配,该模型需要精确地调节神经元的放电强度,和真实神经元放电过程的高噪声特性不符。赵冬晔等[92]对感知记忆神经环路的整体架构进行建模,提出了整合感知和运动信息的认知地图学习模型。模型包括感知觉脑区和记忆脑区,其中内嗅皮层和海马体之间具有并行的通路。视觉脑区由深度卷积神经网络模拟,把视觉信息编码后传递给外侧内嗅皮层。运动脑区的速度信息经由内侧内嗅皮层形成周期性的多尺度位置编码。海马体的位置细胞通过循环连接构成一个循环网络,整合外侧内嗅皮层和内侧内嗅皮层2个并行通路输入的视觉信息与运动信息。脑区之间的连接通过赫布型学习进行更新。在学习机制的驱动下,位置细胞形成空间位置编码。通过感知-记忆的多层级框架,基于无监督学习的感知记忆神经环路模型把感知和运动信息流转换成具有内在结构的认知地图,编码位置关系。认知地图表达的位置信息可以由输出网络进行解码,支持智能体在环境中完成定位。
4 类脑机器人导航(Brain-inspired robot navigation)
导航是动物和机器人与环境交互必须具备的认知功能之一。如何应用空间认知的可计算模型发展复杂环境中的机器人导航算法是跨学科研究的一个热点问题。随着空间认知理论的发展,类脑导航系统日益完善,发展出一系列软件系统和硬件架构。
4.1 基于海马体的类脑导航
早期的类脑机器人导航方法集中在对海马体位置细胞的模拟。美国麻省理工学院的Bachelder等[94]提出了一个位置细胞模型整合视觉感知通路的“什么”和“哪里”信息。这一模型通过自组织学习的方法产生类似海马体位置细胞的放电模式,在移动机器人上完成空间导航任务。苏黎世联邦理工学院的Verschure等[95]构建了一个包含短期记忆和长期记忆神经网络的分布式自适应控制模型,能够让移动机器人产生趋利避害的自适应行为,形成对环境位置的记忆。澳大利亚昆士兰理工大学的Milford及其合作者[96]建立了基于海马体空间编码与视觉感知编码联合表征的RatSLAM系统,使用连续吸引子网络模型跟踪移动机器人的位姿,构建室内环境的拓扑地图。在后续工作中,他们扩展了RatSLAM系统,在大尺寸、光照变化的室外环境中实现了自主定位和地图构建[93, 97]。RatSLAM算法主要分为3个部分:局部视图细胞、位姿细胞、经验地图。机器人从外界环境中感知到视觉信息并从中提取机器人运动的角速度和线速度。运动速度提供给由位姿细胞构成的连续吸引子网络更新网络状态,实现对机器人位姿的跟踪,完成路径积分的功能(图 6)。局部视图细胞对环境的局部场景进行编码。局部视图神经元群体与位姿神经元群体之间通过关联学习建立连接,从而使位姿细胞的状态锚定到环境的视觉特征上,减小累积误差。经验地图根据位姿细胞和局部视图细胞的状态建立节点和连边,构成表征空间位置关系的拓扑地图。RatSLAM系统通过模拟海马体神经元的空间编码机制解决室内外环境下机器人的同步定位与地图构建问题。RatSLAM的性能对模型参数比较敏感,计算代价随环境尺寸的增大而增长较快,因此在适应大尺寸异构环境时面临挑战。
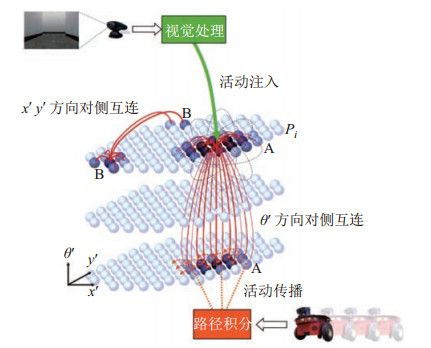 图 6 RatSLAM结构示意图[93] Fig.6 Architecture of RatSLAM
图 6 RatSLAM结构示意图[93] Fig.6 Architecture of RatSLAM 4.2 基于内嗅皮层-海马体神经环路的类脑导航
随着神经科学对内嗅皮层-海马体神经环路的深入研究,栅格细胞的神经信息处理机制得到了进一步解释,相关研究重点也逐渐从位置细胞转移至栅格细胞。栅格细胞的编码和计算机制不断被借鉴用于开发新的类脑导航算法,进而实现在机器人智能导航领域的应用[93, 98-107]。
袁苗龙等[99]搭建了基于栅格细胞和位置细胞的机器人导航系统。相较于之前的类脑导航方法,此模型更注重仿生性,对内嗅皮层-海马体神经通路进行建模(图 7)。模型通过对运动信息进行路径积分来生成多尺度的栅格编码,利用竞争性赫布型学习算法把栅格编码转换成位置细胞的放电模式;环境中的视觉感知信息被用来修正路径积分过程中的累积误差。在真实的办公室环境中进行了认知地图构建,验证了该类脑导航模型在机器人定位和地图构建上的有效性。
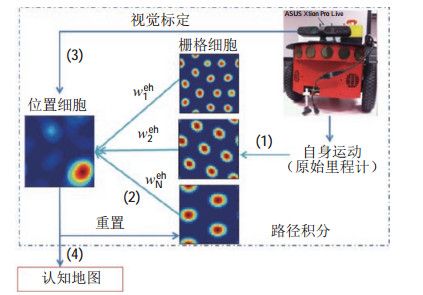 图 7 用于认知地图构建的内嗅皮层-海马区模型[99] Fig.7 Entorhinal-hippocampal model for cognitive mapping
图 7 用于认知地图构建的内嗅皮层-海马区模型[99] Fig.7 Entorhinal-hippocampal model for cognitive mapping 曾太平等[102]借鉴内嗅皮层栅格细胞的位置和速度联合编码的机制,提出了栅格细胞和头朝向细胞的联合编码连续吸引子网络模型,构建了类脑自主定位和认知地图构建系统。系统中栅格细胞和头朝向细胞使用统一的信息整合机制(图 8),分别产生空间位置的三角栅格状编码和方位编码。头朝向细胞神经网络和栅格细胞神经网络利用神经动力学机制纠正累积误差,形成稳定的吸引子,在大尺寸环境中能稳健地编码方向和位置,为自主导航提供方向和位置坐标系。利用该系统在室外大范围环境中完成了机器人自定位和认知地图构建。他们进一步借鉴大脑整合多源信息的神经机制,构建了感知-运动信息贝叶斯整合模型NeuroBayesSLAM[107]。该模型简化了连续吸引子网络的神经动力学,建立了贝叶斯吸引子动力系统,并以此作为统一的计算框架分别为头朝向细胞和栅格细胞建立贝叶斯吸引子网络,整合角速度和线速度形成方位和位置编码。利用贝叶斯多源信息整合机制,根据视觉信息和运动信息的不确定性对头朝向细胞网络和栅格细胞网络的激活状态进行校正。运动信息和感知信息根据不确定程度互相抑制,通过竞争在网络中形成最优的神经表征。当机器人回到环境的熟悉区域构成闭环时,根据感知信息修正位置之间的空间关系,消除运动信息和感知信息之间的误差。模型通过运动信息和感知信息的竞争持续地整合信息流,直到证据累积足够充分后再作出闭环的决策。室内环境和大规模室外环境中的实验表明,感知-运动信息贝叶斯整合模型能够保持多源信息并进行动态累积,很好地解决了地图构建过程中的闭环问题,能稳定地形成拓扑地图,在多个异质环境中完成长航时的定位和地图构建。
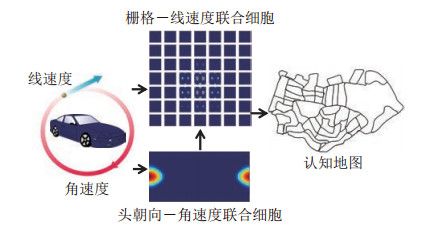 图 8 类脑导航系统通过联合编码的栅格细胞网络和头朝向细胞网络跟踪位姿并构建认知地图[102] Fig.8 Brain-inspired navigation system uses grid cell network and head-direction cell network based on conjunctive encoding mechanism for pose tracking and cognitive mapping
图 8 类脑导航系统通过联合编码的栅格细胞网络和头朝向细胞网络跟踪位姿并构建认知地图[102] Fig.8 Brain-inspired navigation system uses grid cell network and head-direction cell network based on conjunctive encoding mechanism for pose tracking and cognitive mapping 余芳文等[105]受蝙蝠等动物的3维空间编码启发,基于栅格细胞的编码方式建立了表征3维环境的NeuroSLAM系统。系统包括3维栅格细胞、3维头朝向细胞、局部视图细胞和3维经验地图(图 9)。3维栅格细胞和3维头朝向细胞根据根据视觉信息中提取的运动信息进行3维路径积分,表达机器人在3维空间中的4自由度位姿。该系统在双层停车场和多层室内环境中实现了同步定位与地图构建。这一方法可以进一步扩展应用于无人机在3维空间中进行6自由度的定位和地图构建。
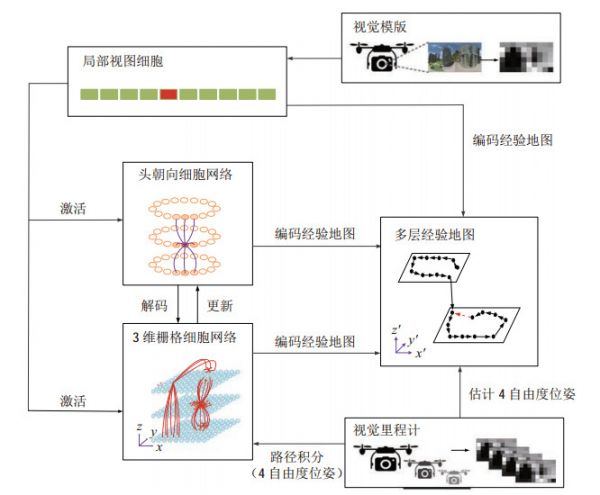 图 9 3维环境下的类脑导航系统[105] Fig.9 Brain-inspired navigation system for 3D environments
图 9 3维环境下的类脑导航系统[105] Fig.9 Brain-inspired navigation system for 3D environments 栅格细胞对距离的编码能力可以用于计算导航所需的位移向量。DeepMind公司的Banino等[106]以长短期记忆(LSTM)网络为基础建立了一个深度学习网络,将其应用在虚拟迷宫环境内的寻路任务,实现了基于栅格编码的向量导航。该模型的输入信息包含视觉信息和运动信息,通过监督学习的方法让输出神经元形成位置和头朝向的神经编码(图 10)。模型能形成环境视觉信息的特征编码,并在中间层形成了类似栅格细胞的栅格状放电模式。通过深度强化学习,这一模型能够优化探索策略,实现基于栅格编码的矢量导航,完成自主定位、空间多尺度表达以及目标点导航等任务。该模型能发现环境中存在的捷径,表明基于哺乳动物空间认知机制的矢量导航模型具有较好的泛化能力、灵活性与自适应性。
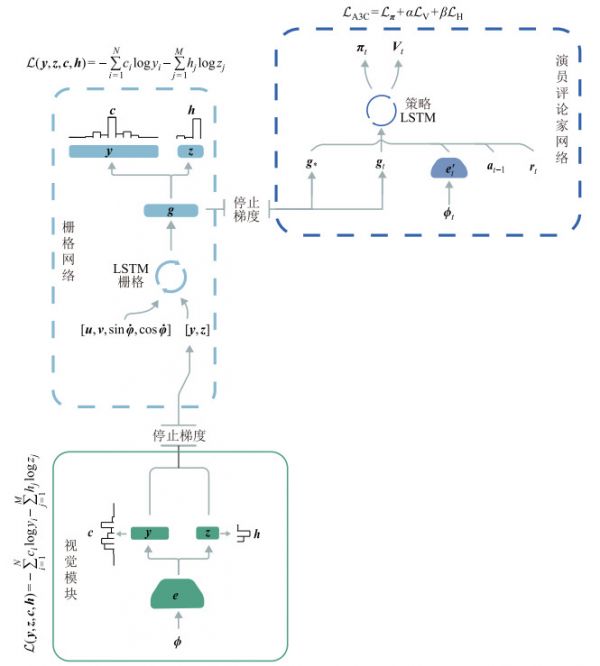 图 10 基于栅格表示的矢量导航模型结构示意图[106] Fig.10 Architecture of vector-based navigation model using grid-like representations
图 10 基于栅格表示的矢量导航模型结构示意图[106] Fig.10 Architecture of vector-based navigation model using grid-like representations Edvardsen等[108]进一步提出一种融合栅格细胞编码和解码机制的神经导航系统,该系统由包含栅格细胞、目标信号及相移检测网络的多个模块构成。栅格细胞基于速度等运动信息输入,通过路径积分形成当前位置表示。相移检测网络对比当前位置表示与目标位置的偏差得到所需的运动方向,控制运动神经元成功地实现目标导航。他们利用该方法解决复杂环境中的避障导航任务(图 11),通过集成栅格细胞的矢量导航机制和位置细胞与边界细胞的局部避障机制,有效地实现了在迷宫环境灵活的目标导航[109]。其核心是栅格细胞矢量导航模块,通过对比当前位置与目标位置的差异得到机器人的运动方向,为模型提供矢量导航功能。位置细胞模块与栅格细胞模块直接关联,确定了矢量导航的起点或终点,反映了环境区域间的拓扑关系,确定与目标间的最短导航路径。系统利用边界细胞作为方向调整机制的输入,引导机器人避开路径上的障碍。矢量导航过程中,导航目的地不一定要与最终目标位置相同,可以在不同的子目标之间改变。当矢量导航或避障失败时,位置细胞为矢量导航重新设置一个更近的子目标[109]。
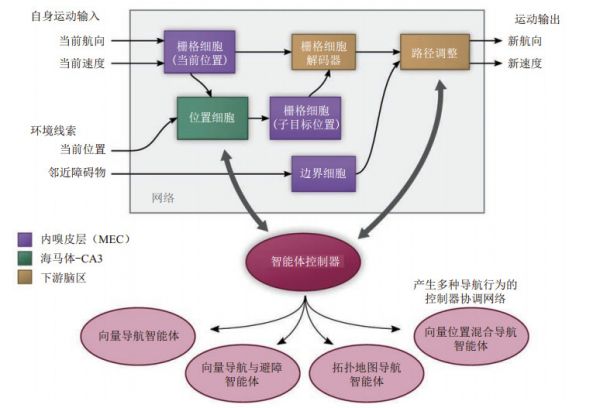 图 11 复杂环境下基于栅格细胞、边界细胞和位置细胞神经表征的避障导航系统[109] Fig.11 Navigation and obstacle avoidance in complex environment based on neural representations of grid cells, border cells and place cells
图 11 复杂环境下基于栅格细胞、边界细胞和位置细胞神经表征的避障导航系统[109] Fig.11 Navigation and obstacle avoidance in complex environment based on neural representations of grid cells, border cells and place cells 内嗅皮层-海马体神经环路在情景记忆中也发挥重要作用。情景记忆形成机制能启发构建机器人的环境认知算法[103-104, 110]。邹强等[110]提出一种基于情景记忆的自组织学习框架,用于机器人的经验学习、认知地图构建和导航。该框架利用海马体和内嗅皮层的空间细胞对机器人的运动信息进行路径积分,并根据视觉线索进行状态识别,通过持续更新状态神经元网络,构建并存储机器人的情景记忆,实现机器人的自组织学习。通过引入空间细胞相位重置机制优化累积误差,构建描述环境拓扑结构和认知关系的情景认知地图(图 12)。此外,将基于拓扑和度量向量的导航方法相结合,根据机器人在存储空间中的经历进行定位,预测到目标的全局优先路径,并引导移动机器人准确导航到目标。
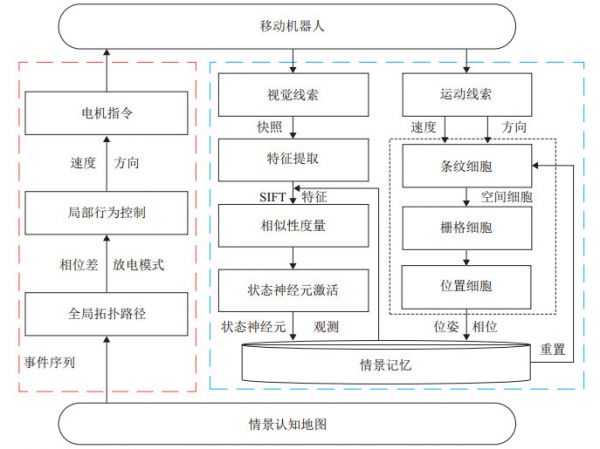 图 12 基于情景记忆的自组织学习框架[110] Fig.12 The episodic memory based self-organizing learning framework
图 12 基于情景记忆的自组织学习框架[110] Fig.12 The episodic memory based self-organizing learning framework 4.3 类脑导航芯片
机器人系统对能耗、响应时间等具有较高的要求。研发类脑导航芯片是类脑导航算法应用于非结构化、大尺寸环境中机器人导航问题的关键。如何构建认知计算的硬件体系一直是智能系统的研究热点。自2008年起,美国国防部高级研究计划局(DARPA)累计投资7000万美元资助IBM和哥伦比亚大学等公司和科研院所研究仿脑的认知计算机。该项目名为SyNAPSE,目标是研制类似神经元的硬件计算单元以及神经元之间可调控的纳米级电子突触,进而模拟大脑的计算和学习功能,便于应用在智能机器人等系统上。2014年,他们成功地研制出TrueNorth芯片,在硬件上实现深度学习算法,完成实时目标检测[111]。TrueNorth芯片的单位能耗远低于基于冯·诺伊曼结构的通用数字芯片,与大脑的能耗类似。他们正在将其应用在海洋观测等低能耗的应用中。法国达索公司研制了“神经元”无人机nEUROn,采用神经网络和人工智能的方法,具有目标自动捕获和自主识别、编队控制和信息融合等功能。该无人机从2014年开始装备法国空军。2019年,清华大学的裴京等[112]设计开发了面向人工通用智能的世界首款异构融合类脑计算芯片“天机芯”。天机芯融合了计算机科学导向和神经科学导向的计算架构,能同时运行抽象的人工神经网络模型和具有生物合理性的脉冲神经网络模型。天机芯可运行多种算法和模型,控制无人驾驶自行车系统,实时地完成目标检测、跟踪、语音控制、避障和平衡控制等任务。
类脑计算平台的研发为类脑导航系统提供了高性能的计算架构。美国神经科学研究所的Fleischer等[113]开发了可以完成导航和决策任务的类脑计算芯片和机器人系统。这一类脑计算系统模拟了包括视觉、内嗅皮层、海马结构等脑区在内的神经系统,能够整合触觉、视觉、距离和方向感等多模态信息,通过自组织学习和强化学习形成位置和轨迹的联合编码,完成到达目标位置的导航任务。Zeno等[114]在现场可编程门阵列(FPGA)上开发了类脑导航模型,模拟边界细胞、视觉位置细胞和位置细胞等的编码模式,在机器人上实现了定位和路径规划等任务。Krishna等[115]利用FPGA实现了一个由栅格细胞、位置细胞构成的多层级网络模型,并且通过一个解码网络根据位置细胞群体的放电状态来预测空间位置。模型中,栅格细胞与位置细胞之间的连接根据神经生物学实验所发现的栅格细胞模块化分布进行设计,解码网络的连接权重根据监督学习的方法进行离线训练。网络的连接权重加载到FPGA芯片上实现加速。它们在仿真环境中验证了仿生定位方法的精确性。类脑计算芯片能更快速地对不同环境下的导航任务进行建模,进而实现智能机器人类脑导航技术在大尺寸环境中的开发与应用。
5 现存的问题与挑战(Existing problems and challenges)
随着脑科学和机器人学的融合发展,许多国家都围绕类脑导航技术在理论、算法和系统研发等多个方面开展了深入的研究。表 1列举了部分具有代表性的类脑导航系统。
 表 1 类脑导航应用 Tab. 1 Applications of brain-inspired navigation
表 1 类脑导航应用 Tab. 1 Applications of brain-inspired navigation 类脑导航技术的研究仍然面临诸多问题与挑战。首先,脑科学与机器人学的融合有待进一步加强。构建先进的导航系统需要机器人学、神经信息科学、脑科学等多学科交叉研究[116]。近年来兴起的深度卷积神经网络借鉴了大脑视觉神经环路的多层级信息处理机制,初步展现了脑科学与人工智能交叉融合带来的颠覆性力量,同时也表明引入脑科学的数据和原理作为约束能够提升模型的表征能力。随着脑成像技术的进步,越来越多的高维度、高时空分辨率的脑活动观测手段被用来揭示脑区间信息传递的动态过程[117-121]。高维脑活动数据为建立脑网络的计算神经科学模型和类脑智能算法奠定了基础。从脑机制出发研究类脑智能系统是新一代人工智能研究的方法论[26, 122-123]。其次,如何达到对环境的理解是类脑导航技术需要进一步深入研究的核心问题。从感知信息中获得对环境的认知是智能机器人适应环境的关键。现有的机器人导航方法通常关注机器人位姿和环境特征的表征,往往忽视环境语义信息和结构信息的表征。理解环境是认知智能的重要体现。建立环境的高层级认知地图表征能够提取环境中与任务相关的结构性信息,避免将计算和存储资源消耗在底层特征的维护上[124]。建立认知层次的模型和表征不仅能够提升计算效率,也能使系统具有更强的泛化能力和鲁棒性。此外,大脑信息处理机制具有高度的复杂性。神经元之间的连接错综复杂,通过神经环路对多种外界输入信息进行整合、处理。模拟和再现这些复杂的信息处理过程需要先进的神经计算模型,消耗大量的计算机算力。如果进一步加入神经元放电的时间关系、连接模式、神经元的动态过程等机制,计算量无疑会更大。因此,从计算神经科学角度建立完善的脑模拟平台和类脑计算架构是当前类脑导航研究面临的一项巨大挑战,需要多学科科研人员的协同攻关。
6 总结与展望(Conclusions and prospects)
类脑导航借鉴了大脑的组织结构和信息处理机制,将机器视觉技术、计算神经科学模型与机器人导航技术相融合,以实现大尺度、非结构化环境中移动机器人的环境感知与空间记忆为目标,在硬件架构、编码方式与软件算法等多个层面提升智能体的认知水平,打造智能移动机器人。脑认知科学的基础研究是类脑导航发展的基石,而将机器人导航、人工智能技术与脑认知科学紧密结合则是类脑导航发展的重要推动力。
为了使移动机器人具备更为鲁棒的认知能力,实现稳定、自主、智能的导航方案,未来工作可在多个方向展开深入研究,譬如:1) 多源感知信息融合,视觉、听觉、嗅觉等多感知信息的特征提取与整合能够有效提高仿生导航模型的鲁棒能力,为类脑导航的实现奠定基础;2) 多脑区协作,空间记忆不仅仅是脑功能的一个孤立模块,内嗅皮层、海马结构与其他感知、学习、决策相关脑区的联合研究有助于建立更为完整的哺乳动物大脑内部GPS模型,为理解脑的通用组织规则提供更多的理论和计算依据;3) 多种地图表征形式相互补充,高层级的全局地图有利于路径规划、全局定位等任务,基于特征的局部地图便于避障和位置识别,综合利用多种地图类型可以实现高效灵活的导航。
参考文献(References)
[1]Durrant-Whyte H, Bailey T. Simultaneous localization and mapping: Part Ⅰ[J]. IEEE Robotics & Automation Magazine, 2006, 13(2): 99-110.
[2]Bailey T, Durrant-Whyte H. Simultaneous localization and mapping (SLAM): Part Ⅱ[J]. IEEE Robotics & Automation Magazine, 2006, 13(3): 108-117.
[3]Montemerlo M, Thrun S, Koller D, et al. FastSLAM: A factored solution to the simultaneous localization and mapping problem[C]//AAAI National Conference on Artificial Intelligence. Washington, USA: AAAI, 2002: 593-598.
[4]Grisetti G, Tipaldi G D, Stachniss C, et al. Fast and accurate SLAM with Rao-Blackwellized particle filters[J]. Robotics and Autonomous Systems, 2007, 55(1): 30-38. DOI:10.1016/j.robot.2006.06.007
[5]Klein G, Murray D. Parallel tracking and mapping for small AR workspaces[C]//6th IEEE and ACM International Symposium on Mixed and Augmented Reality. Piscataway, USA: IEEE, 2007: 225-234.
[6]Mur-Artal R, Montiel J M M, Tardiós J D. ORB-SLAM: A versatile and accurate monocular SLAM system[J]. IEEE Transactions on Robotics, 2015, 31(5): 1147-1163. DOI:10.1109/TRO.2015.2463671
[7]Mur-Artal R, Tardós J D. ORB-SLAM2:An open-source SLAM system for monocular, stereo, and RGB-D cameras[J]. IEEE Transactions on Robotics, 2017, 33(5): 1255-1262. DOI:10.1109/TRO.2017.2705103
[8]Campos C, Elvira R, Rodríguez J J G, et al. ORB-SLAM3:An accurate open-source library for visual, visual-inertial, and multimap SLAM[J]. IEEE Transactions on Robotics, 2021, 37(6): 1874-1890. DOI:10.1109/TRO.2021.3075644
[9]Strasdat H, Montiel J M M, Davison A J. Visual SLAM: Why filter?[J]. Image and Vision Computing, 2012, 30(2): 65-77. DOI:10.1016/j.imavis.2012.02.009
[10]Li R H, Wang S, Long Z Q, et al. UnDeepVO: Monocular visual odometry through unsupervised deep learning[C]//IEEE International Conference on Robotics and Automation. Piscataway, USA: IEEE, 2018: 7286-7291.
[11]Xiao L H, Wang J G, Qiu X S, et al. Dynamic-SLAM: Semantic monocular visual localization and mapping based on deep learning in dynamic environment[J]. Robotics and Autonomous Systems, 2019, 117: 1-16. DOI:10.1016/j.robot.2019.03.012
[12]Zhan H Y, Weerasekera C S, Bian J W, et al. Visual odometry revisited: What should be learnt?[C]//IEEE International Conference on Robotics and Automation. Piscataway, USA: IEEE, 2020: 4203-4210.
[13]Teed Z, Deng J. DROID-SLAM: Deep visual SLAM for monocular, stereo, and RGB-D cameras[C]//Advances in Neural Information Processing Systems 34. Red Hook, USA: Curran Associates Inc., 2021: 16558-16569.
[14]Yin H, Chen R J, Wang Y, et al. RaLL: End-to-end radar localization on lidar map using differentiable measurement model[J]. IEEE Transactions on Intelligent Transportation Systems, 2022, 23(7): 6737-6750. DOI:10.1109/TITS.2021.3061165
[15]Yang S F, Wang J N, Wang G J, et al. Robust RGB-D SLAM in dynamic environment using faster R-CNN[C]//IEEE International Conference on Computer and Communications. Piscataway, USA: IEEE, 2017: 2398-2402.
[16]Cheng J Y, Zhang H, Meng M Q H. Improving visual localization accuracy in dynamic environments based on dynamic region removal[J]. IEEE Transactions on Automation Science and Engineering, 2020, 17(3): 1585-1596.
[17]Jeffery K J. Spatial cognition: Entorhinal cortex and the hippocampal place-cell map[J]. Current Biology, 2015, 25(24): 1181-1183. DOI:10.1016/j.cub.2015.10.048
[18]von Frisch K. The dance language and orientation of bees[M]. Cambridge, USA: Harvard University Press, 2013.
[19]O'Keefe J, Nadel L. The hippocampus as a cognitive map[M]. Oxford, UK: Oxford Press, 1978.
[20]Robertson R G, Rolls E T, Georges-Francois P, et al. Head direction cells in the primate pre-subiculum[J]. Hippocampus, 1999, 9(3): 206-219. DOI:10.1002/(SICI)1098-1063(1999)9:3<206::AID-HIPO2>3.0.CO;2-H
[21]Hafting T, Fyhn M, Molden S, et al. Microstructure of a spatial map in the entorhinal cortex[J]. Nature, 2005, 436(7052): 801-806. DOI:10.1038/nature03721
[22]Fyhn M, Hafting T, Treves A, et al. Hippocampal remapping and grid realignment in entorhinal cortex[J]. Nature, 2007, 446(7132): 190-194. DOI:10.1038/nature05601
[23]Kennedy D, Norman C. What don't we know?[J]. Science, 2005, 309(5731): 75. DOI:10.1126/science.309.5731.75
[24]Miller G. How are memories stored and retrieved?[J]. Science, 2005, 309(5731): 92. DOI:10.1126/science.309.5731.92
[25]NAE. NAE grand challenges for engineering[EB/OL]. [2022-03-01]. http://www.engineeringchallenges.org/challenges.aspx.
[26]Ullman S. Using neuroscience to develop artificial intelligence[J]. Science, 2019, 363(6428): 692-693. DOI:10.1126/science.aau6595
[27] 吴德伟, 何晶, 韩昆, 等. 无人作战平台认知导航及其类脑实现思想[J]. 空军工程大学学报(自然科学版), 2018, 19(6): 37-42.
Wu D W, He J, Han K, et al. Cognitive navigation and its thought of brain-inspired realization in unmanned combat platform[J]. Journal of Air Force Engineering University (Natural Science Edition), 2018, 19(6): 37-42.
Tolman E C. Cognitive maps in rats and men[J]. Psychological Review, 1948, 55(4): 189-208. DOI:10.1037/h0061626
[29]Teng E, Squire L R. Memory for places learned long ago is intact after hippocampal damage[J]. Nature, 1999, 400(6745): 675-677. DOI:10.1038/23276
[30]Morris R. Developments of a water-maze procedure for studying spatial learning in the rat[J]. Journal of Neuroscience Methods, 1984, 11(1): 47-60. DOI:10.1016/0165-0270(84)90007-4
[31]Fenton A A. Coordinating with the "Inner GPS"[J]. Hippocampus, 2015, 25(6): 763-769. DOI:10.1002/hipo.22451
[32]Geerts J P, Chersi F, Stachenfeld K L, et al. A general model of hippocampal and dorsal striatal learning and decision making[J]. PNAS, 2020, 117(49): 31427-31437. DOI:10.1073/pnas.2007981117
[33]Li Y D, Xu J M, Liu Y F, et al. A distinct entorhinal cortex to hippocampal CA1 direct circuit for olfactory associative learning[J]. Nature Neuroscience, 2017, 20(4): 559-570. DOI:10.1038/nn.4517
[34]Lisman J E, Grace A A. The hippocampal-VTA loop: Controlling the entry of information into long-term memory[J]. Neuron, 2005, 46(5): 703-713. DOI:10.1016/j.neuron.2005.05.002
[35]Grieves R M, Jeffery K J. The representation of space in the brain[J]. Behavioural Processes, 2017, 135: 113-131. DOI:10.1016/j.beproc.2016.12.012
[36]Kitamura T, Macdonald C J, Tonegawa S. Entorhinalhippocampal neuronal circuits bridge temporally discontiguous events[J]. Learning & Memory, 2015, 22(9): 438-443.
[37]McNamee D C, Stachenfeld K L, Botvinick M M, et al. Flexible modulation of sequence generation in the entorhinalhippocampal system[J]. Nature Neuroscience, 2021, 24(6): 851-862. DOI:10.1038/s41593-021-00831-7
[38]O'Keefe J, Dostrovsky J. The hippocampus as a spatial map. Preliminary evidence from unit activity in the freely-moving rat[J]. Brain Research, 1971, 34(1): 171-175. DOI:10.1016/0006-8993(71)90358-1
[39]O'Keefe J. Place units in the hippocampus of the freely moving rat[J]. Experimental Neurology, 1976, 51(1): 78-109. DOI:10.1016/0014-4886(76)90055-8
[40]Giovannangeli C, Gaussier P, Desilles G. Robust mapless outdoor vision-based navigation[C]//IEEE/RSJ International Conference on Intelligent Robots and Systems. Piscataway, USA: IEEE, 2006: 98-109.
[41]Park E, Dvorak D, Fenton A A. Ensemble place codes in hippocampus: CA1, CA3, and dentate gyrus place cells have multiple place fields in large environments[J]. PLoS One, 2011, 6(7): 231-243.
[42]Jankowski M M, O'Mara S M. Dynamics of place, boundary and object encoding in rat anterior claustrum[J]. Frontiers in Behavioral Neuroscience, 2015, 9: 250-259.
[43]Colgin L L, Moser E I, Moser M-B. Understanding memory through hippocampal remapping[J]. Trends in Neurosciences, 2008, 31(9): 469-477. DOI:10.1016/j.tins.2008.06.008
[44]Quirk G J, Muller R U, Kubie J L. The firing of hippocampal place cells in the dark depends on the rat's recent experience[J]. The Journal of Neuroscience, 1990, 10(6): 2008-2017. DOI:10.1523/JNEUROSCI.10-06-02008.1990
[45]Renno-Costa C, Lisman J E, Verschure P F M J. The mechanism of rate remapping in the dentate gyrus[J]. Neuron, 2010, 68(6): 1051-1058. DOI:10.1016/j.neuron.2010.11.024
[46]Jeffery K J. Integration of the sensory inputs to place cells: What, where, why, and how?[J]. Hippocampus, 2007, 17(9): 775-785. DOI:10.1002/hipo.20322
[47]Chen G, King J A, Burgess N, et al. How vision and movement combine in the hippocampal place code[J]. PNAS, 2012, 110(1): 378-383.
[48]Pasqualotto A, Newell F N. The role of visual experience on the representation and updating of novel haptic scenes[J]. Brain and Cognition, 2007, 65(2): 184-194. DOI:10.1016/j.bandc.2007.07.009
[49]Pickering S J. The development of visuo-spatial working memory[J]. Memory, 2001, 9(4-6): 423-432. DOI:10.1080/09658210143000182
[50]Stensola H, Stensola T, Solstad T, et al. The entorhinal grid map is discretized[J]. Nature, 2012, 492(7427): 72-78. DOI:10.1038/nature11649
[51]Moser E I, Kropff E, Moser M-B. Place cells, grid cells, and the brain's spatial representation system[J]. Annual Review of Neuroscience, 2008, 31(1): 69-89. DOI:10.1146/annurev.neuro.31.061307.090723
[52]Fyhn M, Molden S, Witter M P, et al. Spatial representation in the entorhinal cortex[J]. Science, 2004, 305(5688): 1258-1264. DOI:10.1126/science.1099901
[53]Sargolini F, Fyhn M, Hafting T, et al. Conjunctive representation of position, direction, and velocity in entorhinal cortex[J]. Science, 2006, 312(5774): 758-762. DOI:10.1126/science.1125572
[54]Solstad T, Boccara C N, Kropff E, et al. Representation of geometric borders in the entorhinal cortex[J]. Science, 2008, 322(5909): 1865-1868. DOI:10.1126/science.1166466
[55]Bush D, Barry C, Manson D, et al. Using grid cells for navigation[J]. Neuron, 2015, 87(3): 507-520. DOI:10.1016/j.neuron.2015.07.006
[56]Deshmukh S S, Knierim J J. Representation of non-spatial and spatial information in the lateral entorhinal cortex[J]. Frontiers in Behavioral Neuroscience, 2011, 5: 69-78.
[57]Tsao A, Moser M-B, Moser E I. Traces of experience in the lateral entorhinal cortex[J]. Current Biology, 2013, 23(5): 399-405. DOI:10.1016/j.cub.2013.01.036
[58]Wang C, Chen X, Lee H, et al. Egocentric coding of external items in the lateral entorhinal cortex[J]. Science, 2018, 362(6417): 945-949. DOI:10.1126/science.aau4940
[59]Tsao A, Sugar J, Lu L, et al. Integrating time from experience in the lateral entorhinal cortex[J]. Nature, 2018, 561(7721): 57-62. DOI:10.1038/s41586-018-0459-6
[60]Wang C, Chen X, Knierim J J. Egocentric and allocentric representations of space in the rodent brain[J]. Current Opinion in Neurobiology, 2020, 60: 12-20. DOI:10.1016/j.conb.2019.11.005
[61]Rolls E T, Stringer S M, Elliot T. Entorhinal cortex grid cells can map to hippocampal place cells by competitive learning[J]. Network: Computation in Neural Systems, 2006, 17(4): 447-465. DOI:10.1080/09548980601064846
[62]Si B L, Treves A. The role of competitive learning in the generation of DG fields from EC inputs[J]. Cognitive Neurodynamics, 2009, 3(2): 177-187. DOI:10.1007/s11571-009-9079-z
[63]Monaco J D, Abbott L F. Modular realignment of entorhinal grid cell activity as a basis for hippocampal remapping[J]. Journal of Neuroscience, 2011, 31(25): 9414-9425. DOI:10.1523/JNEUROSCI.1433-11.2011
[64]Tsodyks M, Sejnowski T. Associative memory and hippocampal place cells[J]. International Journal of Neural Systems, 1995, 6: 81-86.
[65]Rowland D C, Roudi Y, Moser M-B, et al. Ten years of grid cells[J]. Annual Review of Neuroscience, 2016, 39: 19-40. DOI:10.1146/annurev-neuro-070815-013824
[66]Giocomo L M, Moser M-B, Moser E I. Computational models of grid cells[J]. Neuron, 2011, 71(4): 589-603. DOI:10.1016/j.neuron.2011.07.023
[67]Burgess N, Barry C, O'Keefe J. An oscillatory interference model of grid cell firing[J]. Hippocampus, 2007, 17(9): 801-812. DOI:10.1002/hipo.20327
[68]Giocomo L M, Zilli E A, Fransén E, et al. Temporal frequency of subthreshold oscillations scales with entorhinal grid cell field spacing[J]. Science, 2007, 315(5819): 1719-1722. DOI:10.1126/science.1139207
[69]Burgess N. Grid cells and theta as oscillatory interference: Theory and predictions[J]. Hippocampus, 2008, 18(12): 1157-1174. DOI:10.1002/hipo.20518
[70]Hasselmo M E. Grid cell mechanisms and function: Contributions of entorhinal persistent spiking and phase resetting[J]. Hippocampus, 2008, 18(12): 1213-1229. DOI:10.1002/hipo.20512
[71]Zilli E A, Hasselmo M E. Coupled noisy spiking neurons as velocity-controlled oscillators in a model of grid cell spatial firing[J]. The Journal of Neuroscience, 2010, 30(41): 13850-13860. DOI:10.1523/JNEUROSCI.0547-10.2010
[72]Wang Y H, Xu X Y, Pan X C, et al. Grid cell activity and path integration on 2-D manifolds in 3-D space[J]. Nonlinear Dynamics, 2021, 104(2): 1767-1780. DOI:10.1007/s11071-021-06337-y
[73]Samsonovich A, McNaughton B L. Path integration and cognitive mapping in a continuous attractor neural network model[J]. The Journal of Neuroscience, 1997, 17(15): 5900-5920. DOI:10.1523/JNEUROSCI.17-15-05900.1997
[74]Fuhs M C, Touretzky D S. A spin glass model of path integration in rat medial entorhinal cortex[J]. The Journal of Neuroscience, 2006, 26(16): 4266-4276. DOI:10.1523/JNEUROSCI.4353-05.2006
[75]McNaughton B L, Battaglia F P, Jensen O, et al. Path integration and the neural basis of the 'cognitive map'[J]. Nature Reviews: Neuroscience, 2006, 7: 663-678.
[76]Guanella A, Kiper D, Verschure P. A model of grid cells based on a twisted torus topology[J]. International Journal of Neural Systems, 2007, 17(4): 231-240. DOI:10.1142/S0129065707001093
[77]Burak Y, Fiete I R. Accurate path integration in continuous attractor network models of grid cells[J]. PLoS Computational Biology, 2009, 5(2): 165-178.
[78]Pastoll H, Solanka L, van Rossum M C W, et al. Feedback inhibition enables theta-nested gamma oscillations and grid firing fields[J]. Neuron, 2013, 77(1): 141-154. DOI:10.1016/j.neuron.2012.11.032
[79]Si B L, Romani S, Tsodyks M. Continuous attractor network model for conjunctive position-by-velocity tuning of grid cells[J]. PLoS Computational Biology, 2014, 10(4): 1-18.
[80]Kropff E, Treves A. The emergence of grid cells: Intelligent design or just adaptation?[J]. Hippocampus, 2008, 18(12): 1256-1269. DOI:10.1002/hipo.20520
[81]Si B L, Kropff E, Treves A. Grid alignment in entorhinal cortex[J]. Biological Cybernetics, 2012, 106(8): 483-506.
[82]Si B L, Treves A. A model for the differentiation between grid and conjunctive units in medial entorhinal cortex[J]. Hippocampus, 2013, 23(12): 1410-1424. DOI:10.1002/hipo.22194
[83]Urdapilleta E, Si B L, Treves A. Selforganization of modular activity of grid cells[J]. Hippocampus, 2017, 27(11): 1204-1213. DOI:10.1002/hipo.22765
[84]D'Albis T, Kempter R. A single-cell spiking model for the origin of grid-cell patterns[J]. PLoS Computational Biology, 2017, 13(10): 82-95.
[85]Stella F, Si B L, Kropff E, et al. Grid maps for spaceflight, anyone? they are for free![J]. Behavioral and Brain Sciences, 2013, 36(5): 566-567.
[86]Stella F, Si B L, Kropff E, et al. Grid cells on the ball[J]. Journal of Statistical Mechanics: Theory and Experiment, 2013, 3(13): 1-15.
[87]Stella F, Treves A. The self-organization of grid cells in 3D[J]. eLife, 2015, 4: 59-76.
[88]Urdapilleta E, Troiani F, Stella F, et al. Can rodents conceive hyperbolic spaces?[J]. Journal of the Royal Society Interface, 2015, 12(107): 1-16.
[89]Cueva C J, Wei X X. Emergence of grid-like representations by training recurrent neural networks to perform spatial localization[C]//International Conference on Learning Representations. 2018.
[90]Xu T, Barak O. Implementing inductive bias for different navigation tasks through diverse RNN attractors[C]//International Conference on Learning Representations. 2020.
[91]Burgess N, Donnett J G, Jeffery K J, et al. Robotic and neuronal simulation of the hippocampus and rat navigation[J]. Philosophical Transactions of the Royal Society B, 1997, 352(1360): 1535-1543. DOI:10.1098/rstb.1997.0140
[92]Zhao D Y, Zhang Z, Lu H, et al. Learning cognitive map representations for navigation by sensory-motor integration[J]. IEEE Transactions on Cybernetics, 2022, 52(1): 508-521. DOI:10.1109/TCYB.2020.2977999
[93]Milford M J, Wiles J, Wyeth G F. Solving navigational uncertainty using grid cells on robots[J]. PLoS Computational Biology, 2010, 6(11): 1-19.
[94]Bachelder I A, Waxman A M. Mobile robot visual mapping and localization: A view-based neurocomputational architecture that emulates hippocampal place learning[J]. Neural Networks, 1994, 7(6-7): 1083-1099. DOI:10.1016/S0893-6080(05)80160-1
[95]Verschure P F M J, Voegtlin T, Douglas R J. Environmentally mediated synergy between perception and behaviour in mobile robots[J]. Nature, 2003, 425(6958): 620-624. DOI:10.1038/nature02024
[96]Milford M J, Wyeth G F, Prasser D. RatSLAM: A hippocampal model for simultaneous localization and mapping[C]//IEEE International Conference on Robotics and Automation. Piscataway, USA: IEEE, 2004: 403-408.
[97]Milford M J, Wyeth G F. Mapping a suburb with a single camera using a biologically inspired SLAM system[J]. IEEE Transactions on Robotics, 2008, 24(5): 1038-1053. DOI:10.1109/TRO.2008.2004520
[98]Tejera G, Barrera A, Llofriu M, et al. Solving uncertainty during robot navigation by integrating grid cell and place cell firing based on rat spatial cognition studies[C]//International Conference on Advanced Robotics. Piscataway, USA: 2013. DOI: 10.1109/ICAR.2013.6766544.
[99]Yuan M L, Tian B, Shim V A, et al. An entorhinalhippocampal model for simultaneous cognitive map building[C]//AAAI Conference on Artificial Intelligence. Washington, USA: IEEE, 2015: 133-153.
[100]Jauffret A, Cuperlier N, Gaussier P. From grid cells and visual place cells to multimodal place cell: A new robotic architecture[J]. Frontiers in Neurorobotics, 2015, 9: 1-16.
[101]Mulas M, Waniek N, Conradt J. Hebbian plasticity realigns grid cell activity with external sensory cues in continuous attractor models[J]. Frontiers in Computational Neuroscience, 2016, 10(13): 13.
[102]Zeng T P, Si B L. Cognitive mapping based on conjunctive representations of space and movement[J]. Frontiers in Neurorobotics, 2017, 11: 61-82. DOI:10.3389/fnbot.2017.00061
[103]Tang H J, Huang W W, Narayanamoorthy A, et al. Cognitive memory and mapping in a brain-like system for robotic navigation[J]. Neural Networks, 2017, 87: 27-37. DOI:10.1016/j.neunet.2016.08.015
[104]Tang H J, Yan R, Tan K C. Cognitive navigation by neuroinspired localization, mapping, and episodic memory[J]. IEEE Transactions on Cognitive and Developmental Systems, 2018, 10(3): 751-761. DOI:10.1109/TCDS.2017.2776965
[105]Yu F W, Shang J G, Hu Y J, et al. NeuroSLAM: A braininspired SLAM system for 3D environments[J]. Biological Cybernetics, 2019, 113(5): 515-545.
[106]Banino A, Barry C, Uria B, et al. Vector-based navigation using grid-like representations in artificial agents[J]. Nature, 2018, 557(7705): 429-433. DOI:10.1038/s41586-018-0102-6
[107]Zeng T P, Tang F Z, Ji D X, et al. NeuroBayesSLAM: Neurobiologically inspired Bayesian integration of multisensory information for robot navigation[J]. Neural Networks, 2020, 126: 21-35. DOI:10.1016/j.neunet.2020.02.023
[108]Edvardsen V. Goal-directed navigation based on path integration and decoding of grid cells in an artificial neural network[J]. Natural Computing, 2019, 18(1): 13-27. DOI:10.1007/s11047-016-9575-0
[109]Edvardsen V, Bicanski A, Burgess N. Navigating with grid and place cells in cluttered environments[J]. Hippocampus, 2020, 30(3): 220-232. DOI:10.1002/hipo.23147
[110]Zou Q, Cong M, Liu D, et al. A neurobiologically inspired mapping and navigating framework for mobile robots[J]. Neurocomputing, 2021, 460: 181-194. DOI:10.1016/j.neucom.2021.07.025
[111]Merolla P A, Arthur J V, Alvarez-Icaza R, et al. A million spiking-neuron integrated circuit with a scalable communication network and interface[J]. Science, 2014, 345(6197): 668-673. DOI:10.1126/science.1254642
[112]Pei J, Deng L, Song S, et al. Towards artificial general intelligence with hybrid Tianjic chip architecture[J]. Nature, 2019, 572(7767): 106-111. DOI:10.1038/s41586-019-1424-8
[113]Fleischer J G, Gally J A, Edelman G M, et al. Retrospective and prospective responses arising in a modeled hippocampus during maze navigation by a brain-based device[J]. PNAS, 2007, 104(9): 3556-3561. DOI:10.1073/pnas.0611571104
[114]Zeno P J, Patel S, Sobh T M. A novel neurophysiological based navigation system[J]. Biologically Inspired Cognitive Architectures, 2017, 22: 67-81. DOI:10.1016/j.bica.2017.09.002
[115]Krishna A, Mittal D, Virupaksha S G, et al. Biomimetic FPGAbased spatial navigation model with grid cells and place cells[J]. Neural Networks, 2021, 139: 45-63. DOI:10.1016/j.neunet.2021.01.028
[116]Schacter D L, Addis D R, Hassabis D, et al. The future of memory: Remembering, imagining, and the brain[J]. Neuron, 2012, 76(4): 677-694.
[117]Li A A, Gong H, Zhang B, et al. Micro-optical sectioning tomography to obtain a high-resolution atlas of the mouse brain[J]. Science, 2010, 330(6009): 1404-1408. DOI:10.1126/science.1191776
[118]Zong W J, Wu R L, Li M L, et al. Fast high-resolution miniature two-photon microscopy for brain imaging in freely behaving mice[J]. Nature Methods, 2017, 14(7): 713-719.
[119]Jun J J, Steinmetz N A, Siegle J H, et al. Fully integrated silicon probes for high-density recording of neural activity[J]. Nature, 2017, 551(7679): 232-236.
[120]Cong L, Wang Z G, Chai Y M, et al. Rapid whole brain imaging of neural activity in freely behaving larval zebrafish (Danio rerio)[J]. eLife, 2017, 6: 153-162.
[121]Liu Y T, Tao C L, Zhang X K, et al. Mesophasic organization of GABAA receptors in hippocampal inhibitory synapses[J]. Nature Neuroscience, 2020, 23(12): 1589-1596.
[122]Gallagher R, Appenzeller T. Beyond reductionism[J]. Science, 1999, 284(5411): 79-89.
[123]Koch C, Laurent G. Complexity and the nervous system[J]. Science, 1999, 284(5411): 96-98.
[124]Zeng T P, Si B L, Feng J F. A theory of geometry representations for spatial navigation[J]. Progress in Neurobiology, 2022, 211. DOI:10.1016/j.pneurobio.2022.102228
相关知识
A Survey on Robot Navigation Based on Mammalian Spatial Cognition
宠物用品DTC品牌独立站Litter Robot营销案例分析
富有情感的机器宠物
基于MQTT的智能宠物追踪系统
鸦科鸟类认知研究回顾
社交媒体对青年政治参与的影响及网络规制的调节作用 ——基于大陆九所高校大学生的调查研究
基于鸟类多样性保护的上海中心城区生态网络构建研究
实验动物模型
36. Development of fire resistant PET fibrous structures based on phosphinate
应用心理学
网址: A Survey on Robot Navigation Based on Mammalian Spatial Cognition https://www.mcbbbk.com/newsview484300.html
| 上一篇: 探索人类行为与环境的关系——空间 |
下一篇: 宠物行业深度:它经济”兴起_宠物 |
推荐分享

- 1养玉米蛇的危害 28694
- 2狗交配为什么会锁住?从狗狗生 7180
- 3我的狗老公李淑敏33——如何 6236
- 4豆柴犬为什么不建议养?可爱的 4637
- 5南京宠物粮食薄荷饼宠物食品包 4563
- 6中国境内禁养的十大鸟种,你知 4429
- 7湖南隆飞尔动物药业有限公司宠 4259
- 8自制狗狗辅食:棉花面纱犬的美 4257
- 9家养水獭多少钱一只正常 4212
- 10广州哪里卖宠物猫狗的选择性多 4122






