1区-郑大一附院: 桂枝芍药知母汤调控肠道菌群和代谢改善大鼠痛风性关节炎
微科盟原创微文,欢迎转发转载。
导读
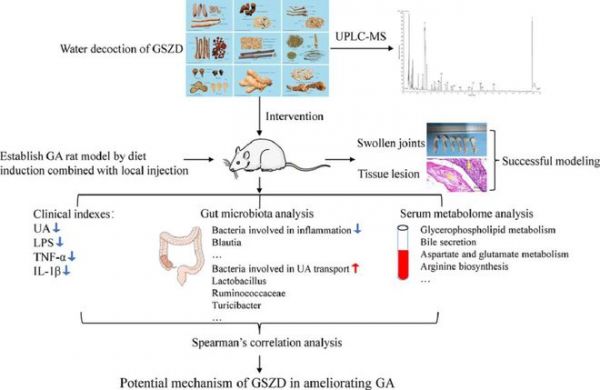
背景:痛风性关节炎(GA)的发病率逐渐升高,现代药物疗法副作用明显。桂枝芍药知母汤(GSZD)是治疗各种骨关节炎的经典中药方剂,在治疗痛风方面具有显著优势。
目的:首次通过对肠道菌群和血清代谢物的综合分析,验证GSZD对痛风的治疗作用并探讨其潜在的药理机制。
方法:我们采用UPLC-MS测定GSZD的化学成分,采用高嘌呤饮食联合局部注射建立GA大鼠模型,21天后采用酶联免疫吸附试验、16S rRNA和非靶向代谢组学检测GSZD的作用及机制,最后进行相关性分析和验证实验,探讨肠道菌群、血清代谢物与GA相关临床指标之间的关联。
结果:我们共鉴定出19个化合物为GSZD。高嘌呤饮食局部注射诱发的关节膨出在GSZD治疗后明显减轻。GSZD改善骨质侵蚀,降低血清炎症因子(脂多糖、肿瘤细胞坏死因子-α和白细胞介素)和GA关键指标(尿酸)水平。16S rRNA分析表明,GSZD治疗的GA大鼠肠道菌群组成存在差异。参与尿酸转运的菌群丰度,包括乳酸杆菌、瘤胃球菌科和Turicibacter,在处理后丰度均有不同程度的升高,而参与炎症反应的细菌丰度,如Blautia,在治疗后明显降低。此外,血清代谢物谱显示与GA改善相关的27种不同代谢物,主要包括脂肪酸、甘油磷脂、嘌呤代谢、氨基酸和胆汁酸,以及主要的代谢途径,如甘油磷脂代谢和丙氨酸。最后,热图相关性分析和验证实验表明炎症细胞因子、肠道微生物种系和代谢参数之间存在密切的关系。
结论:本研究表明GSZD可以通过调节肠道菌群和血清代谢稳态来治疗GA。此外,肠道菌群和血清代谢组学相关性分析的应用为中药复方在骨病治疗中的作用机制提供了启示。
亮点:
1.局部注射高嘌呤诱发大鼠可建立稳定的GA模型。
2.GA在大鼠中存在肠道菌群失调和代谢紊乱。
3.GSZD具有显著的抗痛风作用,可作为治疗药物。
4.GSZD可通过调节肠道菌群和血清代谢稳态来治疗GA。
论文ID
原名:Guizhi Shaoyao Zhimu Decoction ameliorates gouty arthritis in rats via altering gut microbiota and improving metabolic profile
译名:桂枝芍药知母汤通过改变肠道菌群和改善代谢状况改善大鼠痛风性关节炎
期刊:Phytomedicine
IF:6.7
发表时间:2024.06
通讯作者:周政
通讯作者单位:郑州大学第一附属医院
实验设计
实验结果
1.GSZD的化学成分
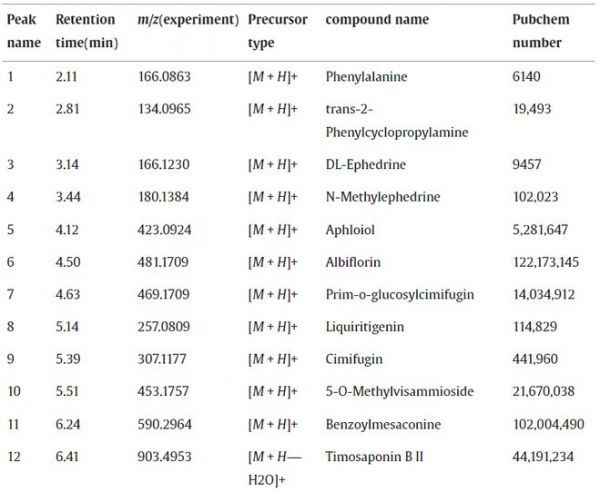
通过识别成分,我们进行了UPLC-MS分析以建立GSZD配方的质量控制,共鉴定出19种成分,包括知母皂苷B-II、升麻素、顺式-o-葡萄糖基升麻素、反式-2-苯基环丙胺等。GSZD 配方的正离子流色谱结果如图 1 所示,19 种化合物及其基本分子式和结构列表列于表 1 中。
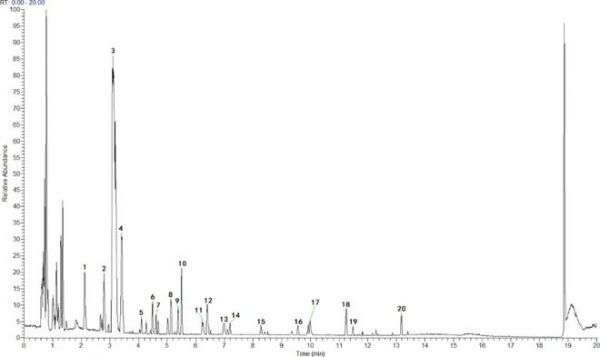
图1 UPLC-MS 正离子模式下 GSZD 总离子色谱图
表1 GSZD 的 UPLC-MS 分析结果

2.GSZD 改善 GA大鼠关节症状并减轻骨质侵蚀
踝关节肿胀是 GA 的常见临床症状。我们通过测量踝周长来计算对照组和治疗组大鼠的踝关节肿胀程度(ASD)。如图 2B 所示,与 CON 相比,关节内注射尿酸结晶(MSU)的大鼠在每个时间点的ASD均明显增加 (p < 0.05);然而,GSZD (3.2 或 1.6 g/kg) 在MSU注射后2、4、8、12、24和48小时显著降低了ASD (p < 0.05)。双氯芬酸钠治疗组(DS) (3 mg/kg/周)治疗在MSU注射后8、24和48小时减轻了水肿形成,并且这种效果一直持续到实验结束。
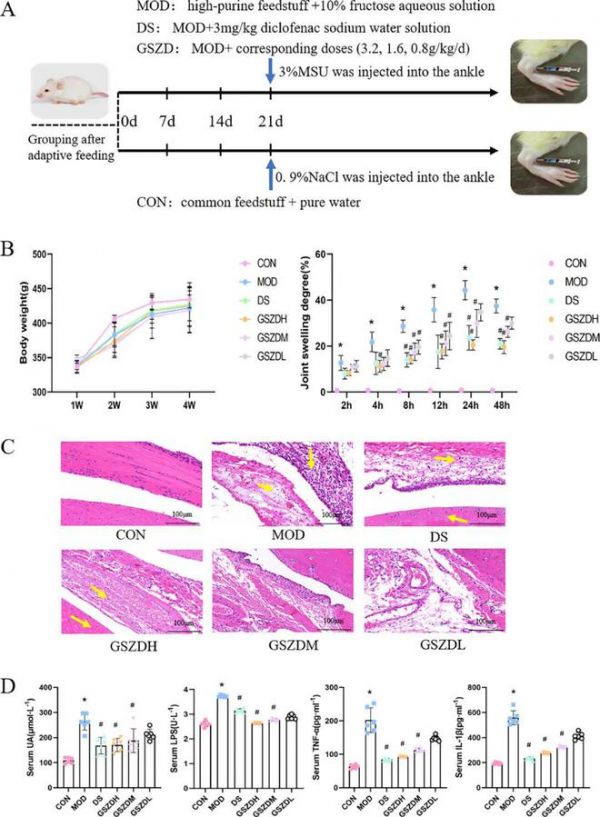
图2 桂枝芍药知母汤对痛风性关节炎大鼠关节症状及骨质侵蚀的药理作用。(A)各组大鼠不同治疗方法的实验设计示意图。(B)各组大鼠体重及关节肿胀程度。(C)膝关节软骨组织切片经苏木精-伊红(H&E)染色。(D)各组大鼠血清UA、LPS、TNF-α及IL-1β水平。CON,对照组;MOD,GA模型组;DS,以3 mg/kg/d剂量双氯芬酸钠治疗的大鼠,GSZDH、GSZDM和GSZDL,以3.2、1.6、0.8 g/kg/d剂量GSZD治疗的大鼠。数值以平均值±S.D(n=6)表示。重复测量方差分析,*p<0.05与CON相比。#p<0.05与MOD相比。
此外,我们使用H&E染色的组织切片评估踝关节滑膜、关节和软骨的组织学变化(图2C)。病理切片显示MOD中滑膜增生,炎症细胞流入滑膜内膜,关节软骨破坏。我们在DS和GSZDH组观察到炎症细胞浸润和滑膜增生减轻。此外,我们观察到GSZD与组织修复之间存在剂量依赖性关系,其中低剂量组大鼠的抗炎浸润和抗增殖特性弱于高剂量组。以上结果提示,GSZD 可改善GA治疗大鼠的关节症状,减轻骨质侵蚀。
此外,我们还检测了血清中炎症因子(LPS、TNF-α 和 IL-1β)和GA的关键指标(UA)的水平,以评估抗痛风的药效学效果。如图 2D 所示,与 CON 相比,MOD 中 LPS、TNF-α、IL-1β 和 UA 的血清水平显著升高(p < 0.05),而暴露于GSZD可防止这种蓄积(p < 0.05)。
根据关节症状和骨质侵蚀的结果,我们发现 GSZD 可以显著降低 ASD,减轻骨质侵蚀,并下调 TNF-α 和 IL-1β 的表达,并且高剂量的 GSZD 比低剂量和中剂量更有效。因此,我们选择药效学效果最好的GSZD高剂量组为代表,开展16S rRNA分析及非靶向代谢组学研究。
3.GSZD调节GA大鼠肠道菌群组成
本研究使用18个肠道内容物样本评估 GSZD 对大鼠痛风症状的抗痛风作用,我们共检测到 1204,809 个高质量reads和5236 个操作分类单元,相似度达到 97%,并进行了注释。随着采样序列数量的增加,稀疏曲线和香农曲线趋于平坦,表明有足够的测序深度可供进一步研究(图 3A)。
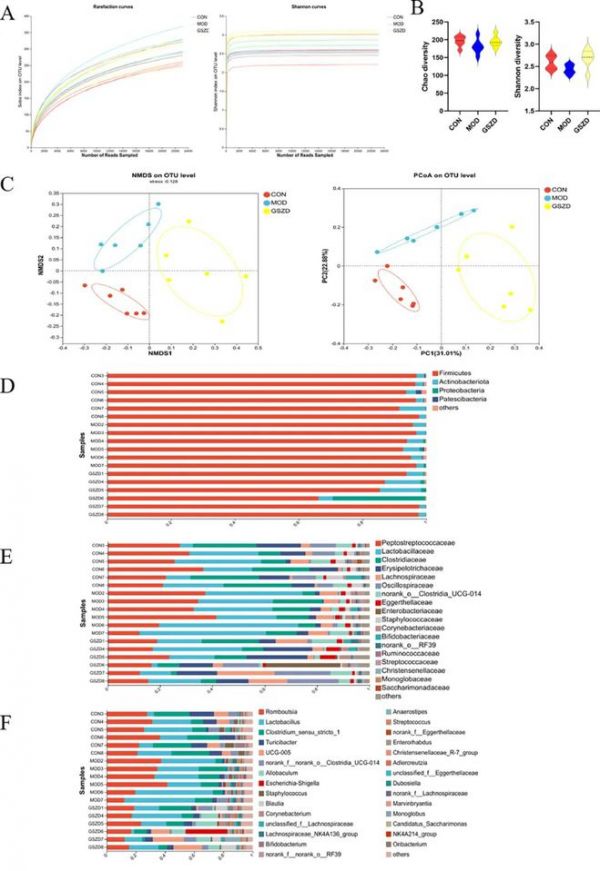
图3 GSZD对GA大鼠肠道菌群组成的影响。(A) 稀疏曲线和 Shannon 曲线。(B) 基于Chao 指数和 Shannon 指数的 α 多样性分析。(C) β 多样性的 NMDS 和PCoA 图。(D) 门水平的肠道菌群细菌分类群分析。(E) 科水平的肠道菌群细菌分类群分析。(F) 属水平的肠道菌群细菌分类群分析。CON,对照组;MOD,GA 模型组;GSZD,以 3.2 g/kg/d 剂量用 GSZD 治疗的大鼠。
如图3B所示,Shannon(多样性指数)和 Chao 指数(丰富度指数)用于 α 多样性分析数据。MOD组的Chao和Shannon指数低于CON组,而GSZD组的Chao和Shannon指数高于MOD组。然而,三组之间的α多样性没有显著差异。
基于Bray-Curtis算法,NMDS和PCoA显示CON、MOD和GSZD组具有各自独特的β多样性聚类(图3C)。值得注意的是,GSZD组的图显示出相同的趋势,并且更接近CON组的图,表明它们的肠道菌群共享相似的位置。这些结果表明,GA对GSZD的改善可能部分与肠道菌群结构的调节有关。在后续实验中,我们继续探讨GSZD调控的肠道菌群的具体分类。
在门水平上,厚壁菌门、放线菌门和变形菌门在各组肠道菌群中起主要作用。与CON相比,MOD中厚壁菌门丰度相对增加,放线菌门丰度相对减少,而GSZDH治疗可逆转这一趋势。此外,GSZD组中变形菌门比例明显降低(图3D)。在科水平上,MOD中丹毒丝菌科、厌氧菌科、产碱菌科和皮杆菌科的相对丰度与CON相比明显降低,而乳酸杆菌科的相对丰度增加。值得注意的是,GSZD给药可逆转药物干预组大鼠中这些细菌群落丰度的趋势(图3E)。接下来,我们探讨了属水平上微生物群落的显著差异。在属水平上,有67 种肠道细菌在 CON 和 MOD 大鼠之间表现出显著差异,有22 种属的水平在 GSZD 治疗后调整至正常水平。值得注意的是,肠道微生物群的丰度,例如Turicibacter、Marvinbryantia、Oribacterium、Ruminococcus_gauvreauii_group、短状杆菌属、德沃斯氏菌属和 寡养杆菌属,在 GA 大鼠中减少,在 GSZD 组中得到显著改善。相反,MOD 组中增加的乳杆菌属、Lachnoclostridium、Butyricicoccus、瘤胃球菌和Lachnospiraceae_UCG-006 丰度在 GSZD 组中显著降低(图 3F)。这些结果证明了 GSZD 对受GA 影响的几个属的水平的有效影响。
此外,我们利用LEfSe方法筛选出3组间差异显著的特定细菌类群(从门到属)(图4)。共计87种特定的关键属被分成3组,其中18种在CON中富集,23种在MOD中富集,46种在GSZD中富集。在这些可区分的类群中,葡萄球菌科、芽孢杆菌科和丹毒丝菌科在CON组中明显更丰富,而毛螺菌科、颤螺旋菌科和Butyricicoccaceae在MOD组中更丰富,相反,丹毒丝菌科、德沃斯氏菌科和微杆菌科在GSZD组中更丰富。这些系统亚型对于区分3组肠道菌群的组成至关重要。综上所述,GSZD在一定程度上改善了GA大鼠的肠道菌群结构。
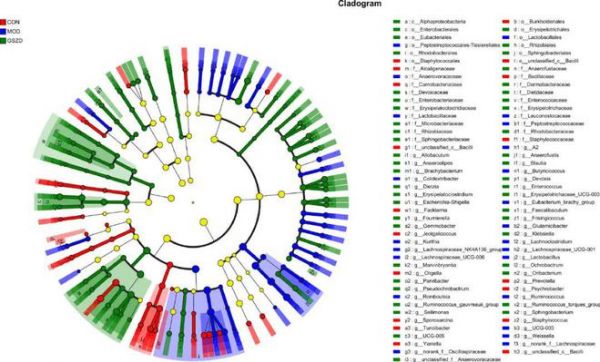
图4 CON、MOD 和 GSZD 组肠道菌群的 LEfSe 比较。CON,对照组;MOD,GA 模型组;GSZD,以 3.2 g/kg/d 剂量给予 GSZD 的大鼠。
4.GSZD 调节 GA大鼠血清代谢组学
我们使用非靶向代谢组学分析研究 GSZD、MOD 和 CON 组血清代谢物差异。根据非监督多变量分析方法 PCA,所有三组的代谢物均有显著差异,尤其是 CON 和 MOD,而 GSZD 样品与 CON 的样品更相似。这表明 GA 大鼠的代谢紊乱可以通过 GSZD 得到改善(图 5A)。
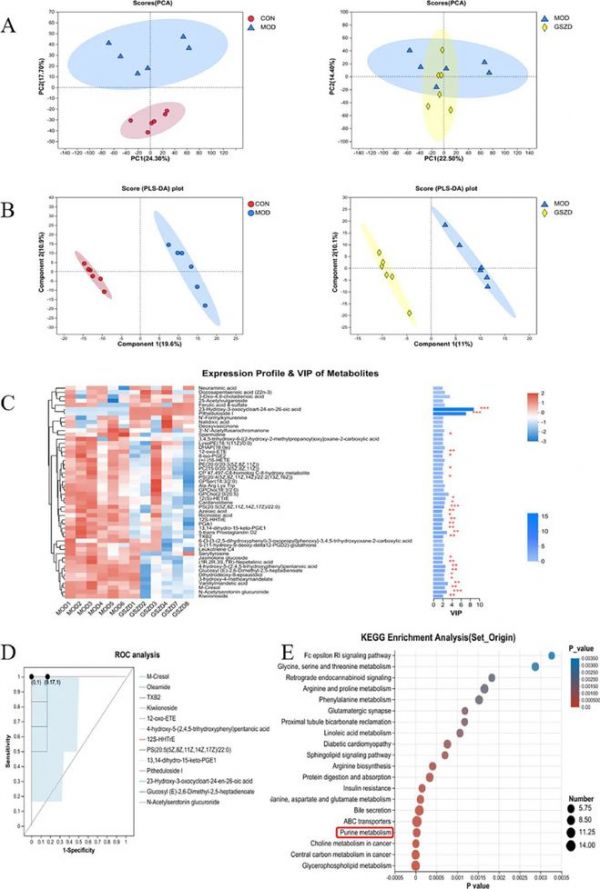
图5 GSZD 干预后大鼠血清代谢谱。(A)负模型中的 PCA 得分图。(B)正模型中的 PLS-DA 得分图。(C)VIP 分析图。(D)ROC 曲线评估 GSZD 抗痛风功效的生物标志物。(E)血清差异代谢物的代谢途径分析。CON,对照组;MOD,GA 模型组;GSZD,以 3.2 g/kg/d 剂量GSZD治疗的大鼠。*统计学上显着差异(p < 0.05)。**统计学上显着差异(p < 0.01)。
随后,我们使用 OPLS-DA 识别代谢物(图 5B)。我们根据 MS/MS 数据和 HMDB(http://www.hmdb.ca/)、Metlin(https://metlin.scripps.edu/)和 Majorbio 数据库搜索和鉴定血清代谢物。我们依据PLS-DA模型获得的VIP值及学生t检验的p值筛选出显著差异代谢物,VIP>1,p < 0.05为显著差异代谢物。我们共鉴定出三组66种差异代谢物。其中,与CON相比,我们获得了39种与GA模型相关的差异代谢物,包括上调的香草基扁桃酸、间甲酚、对甲酚葡萄糖醛酸苷和3‑羟基-4-甲氧基扁桃酸(p < 0.01),下调的7-酮脱氧胆酸、nigellic acid和eremopetasidione (p < 0.05,p < 0.01)。此外,GSZD组与MOD组之间鉴定出27种差异代谢物。与 MOD 相比,GSZD 治疗上调了pitheduloside I 和 23‑羟基-3-氧代环庚-24-烯-26-酸 (p < 0.01),并下调了其他生物标志物 (p < 0.05, p < 0.01)。值得注意的是,MOD 组中香草扁桃酸、M-甲酚、葡萄糖基 (E)−2,6-二甲基-2,5-庚二烯酸酯、3‑羟基-4-甲氧基扁桃酸酯和 12(S)-hetre 等5种代谢物的水平显著降低,而 GSZD 治疗后,所有这些代谢物均恢复正常水平,并受到很大影响 (图 5C)。
我们通过受试者工作特征 (ROC) 曲线分析验证了所识别生物标志物的诊断价值。ROC 曲线基于一系列不同的二分类方法(分区值或决策阈值),以识别对组间区分至关重要的代谢物(生物标志物)变量。ROC 曲线下面积 (AUC) 通常用作诊断效率的指标。AUC>0.90 表明生物标志物可被认为更具诊断价值。ROC 曲线用于筛选 GA 大鼠中 GSZD 干预的潜在生物标志物。如图 5D 所示,其中,pitheduloside I、N-乙酰5-羟色胺葡萄糖醛酸苷、23‑羟基‑3‑氧代环戊‑24‑烯‑26‑酸的AUC为1.0000,12S‑hhtre、kiwiionoside、PS(20:5(5Z,8Z,11Z,14Z,17Z)/22:0)的AUC为0.9722,M‑甲酚、4‑羟基‑5‑(2,4,5‑三羟基苯基)戊酸、txb2、葡萄糖基(e)‑2,6‑二甲基‑2,5‑庚二烯酸酯、13,14‑二氢‑15‑酮‑pge1的AUC为0.9444,油酸酰胺、12‑氧代‑ete的AUC为0.9167。
为探究GSZD干预大鼠可能显著相关的代谢途径,我们将鉴定出的生物标志物导入MetaboAnalyst数据库(http://www.metaboanalyst.ca/),筛选出影响值>0.1的3条重要代谢途径。GSZD最有可能改变的途径包括甘油磷脂代谢、ABC转运体、嘌呤代谢、胆汁分泌、丙氨酸、天冬氨酸和谷氨酸代谢、精氨酸生物合成、谷氨酸能突触和苯丙氨酸代谢(图5E)。
5.肠道菌群、代谢物和 GA 相关指标之间的相关性分析
我们使用Spearman 相关性分析可视化相关性热图,以探究血清代谢物与门、科和属菌群之间的相关性,以及微生物群代谢物与临床指标之间的相关性以及代谢物与临床指标(UA、LPS、TNF-α 和 IL-1β)之间的相关性。
我们观察到肠道菌群紊乱与代谢物谱改变之间存在相关性。如图 6A 所示,在门水平上,12(R)-hete、enantio‑paf c-16、1-硬脂酰甘油磷酸胆碱和 lysoPC(17:0) 与变形菌呈正相关,而三氯乙醇葡萄糖醛酸苷、lysoPC(18:1(9Z))、lysoPC(16:1(9Z))和 pc(18:1/0:0) 与变形菌呈负相关。在科水平上,16‑羟基-10‑氧代十六烷酸、serratol、15‑酮‑13,14‑二氢前列腺素a2、8‑异丙基苯甲酸1、氟利昂酸和前列腺素f1a与毛螺菌科呈正相关,而胆酸、溶血PC(15:0)和PC(16:0/0:0)与其呈负相关(图6B)。在属水平上,溶血PC(18:0)、12(R)‑hete和enantio‑paf c-16与Turicibacter呈正相关,而serratol、氟利昂酸、5‑乙酰氧基二氢茶螺烷和薄荷碳酸乙二醇酯呈负相关(图6C)。
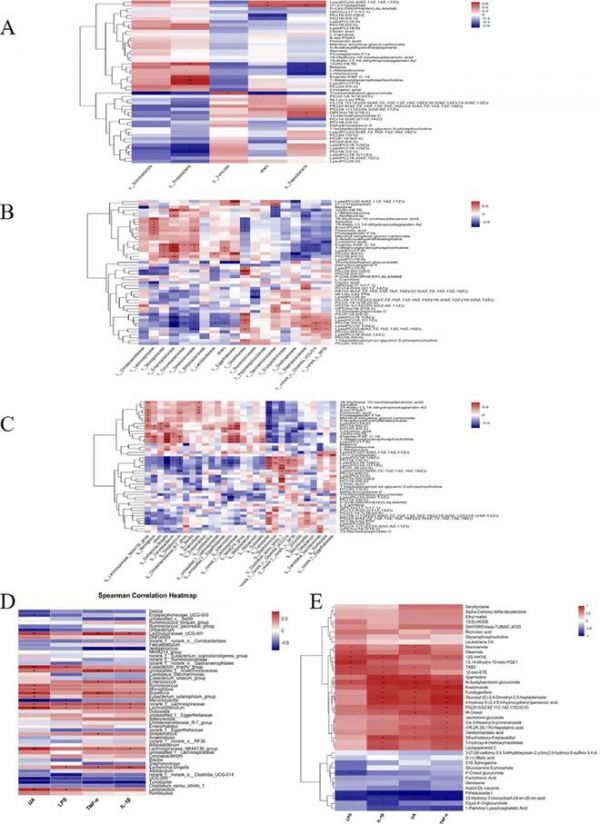
图6 肠道菌群、血清代谢物与 GA 相关临床因素相关性分析热图。(A)肠道菌群与代谢物在门水平上的相关性。(B)肠道菌群与代谢物在科水平上的相关性。(C)肠道菌群与代谢物在属水平上的相关性。(D)肠道菌群与 GA 相关临床因素在属水平上的相关性。(E)血清代谢物与 GA 相关临床因素的相关性。CON,对照组;MOD,GA 模型组;GSZD,以 3.2 g/kg/d 剂量GSZD治疗的大鼠。*统计学上显着差异(p < 0.05)。**统计学上显着差异(p < 0.01)。
在肠道菌群与临床因素相关性的研究中,如图6D所示,我们发现肠道菌群能够显著影响临床因素的表达,如乳酸杆菌与所有临床因素呈正相关,而Turicibacter与大多数临床因素(LPS除外)呈负相关。同样,代谢物也能显著影响临床因素的表达,如氟离子酸的增加会上调临床因素的表达,而溶菌酶pc(16:1(9z))的增加会下调临床因素的表达(图6E)。这些结果表明血清代谢物的变化与肠道菌群的改变或GA相关的临床因素之间存在密切的关系(图7)。
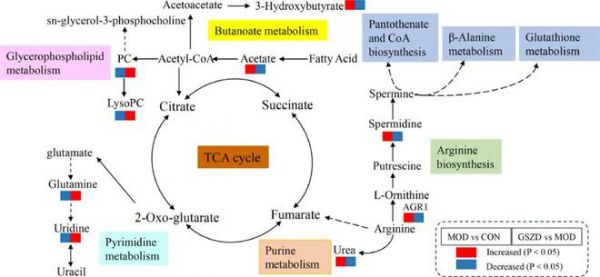
图7 GA潜在代谢途径及GSZD治疗作用
6.GSZD改善嘌呤代谢、抑制炎症
基于上述肠道菌群和血清代谢组学分析,我们发现GSZD可通过调节肠道菌群结构改善嘌呤代谢等生物学过程,进而发挥减轻炎症反应的药效学作用。随后,我们选取相关基因和蛋白质验证研究推论。
结果显示,与嘌呤代谢过程相关的腺核苷去氨酶(ADA)和鸟嘌呤脱氨酶(GDA)关键酶的表达在MOD中显著上调,但在GSZD组中则相反(图8A),提示GSZD可能通过抑制嘌呤代谢关键酶的活性来减少尿酸生成。此外,我们观察到GSZD还增加了回肠组织中Occludin和Zo-1的表达(图8B),提示可能增强了肠道屏障紧密连接。最后,为验证GSZD在痛风性关节炎治疗中能否减轻炎症反应,我们选取LPS的靶受体TLR4炎症通路为代表,检测蛋白活化情况,结果显示MOD大鼠踝关节组织TLR4、MYD88、p-NF-κB P65蛋白表达明显高于CON组,而GSZD干预可下调GA模型大鼠踝关节组织中上述蛋白的表达(图8C)。
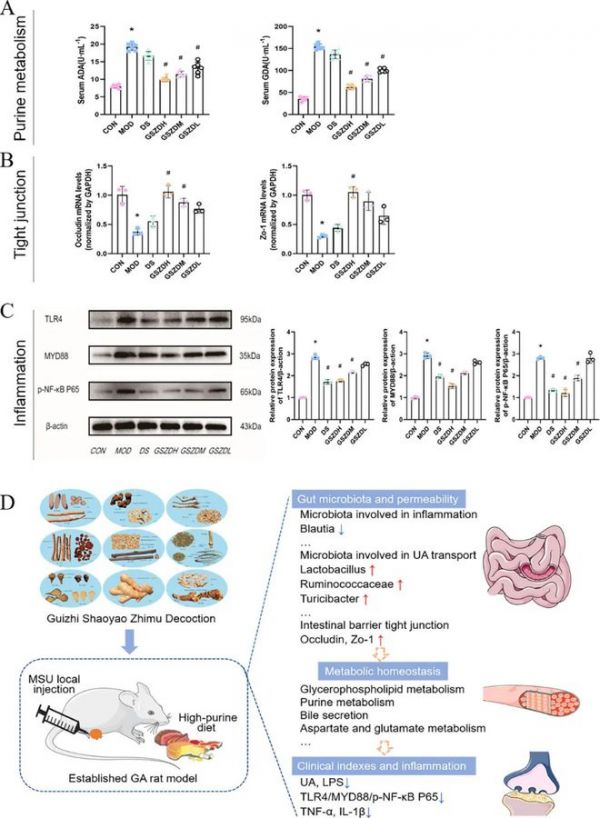
图8 验证实验结果及本研究的图示说明。(A)血清中与嘌呤代谢相关的关键酶(包括 ADA 和 GDA)的表达(n = 6)。(B)回肠紧密连接蛋白、Occludin 和 Zo-1 的mRNA 表达(n = 3)。(C)踝关节样本中炎症的蛋白质表达(包括 TLR4、MYD88 和p-NF-κB P65)(n = 3)。(D)本研究的图示说明。数值以平均值 ± S.D 表示。重复测量方差分析,*p < 0.05 与 CON 相比。#p < 0.05 与 MOD 相比。
GA是一种由嘌呤代谢障碍引起的代谢性疾病,而参与嘌呤代谢的肠道菌群也是代谢性疾病发生的重要致病因素。以往的研究主要关注GA与肠道菌群结构的变化,而忽略了其与代谢物的关系。然而,肠道菌群如何参与痛风性关节炎的发病机制,是否存在“肠-关节”轴通路,以及菌群、代谢物与GA之间的关系仍不清楚。然而,最近的证据表明GA中的微生物组成与代谢物之间存在密切的关联。因此,有必要系统地研究肠道菌群与其代谢物的相关性,以探索GA的干预方法。
GSZD 是数千年来中医治疗 GA 的常用方剂,可能归因于其降低尿酸的能力。在本研究中,我们证明 GSZD 可以降低血清 UA 水平和炎症因子表达,以及减轻关节肿胀和修复组织病理学损伤。基于 16S rRNA基因测序和非靶向代谢组学,我们的研究提供了令人信服的证据,表明 GSZD 通过调节肠道菌群组成和改善代谢失衡来显着缓解 GA。此外,我们的研究结果表明 GSZD 显着影响肠道微生物群、代谢物和临床因素之间的相互作用,这是 GSZD 在 GA 治疗中的潜在机制。
首先,我们使用 UPLC-MS 分析表征 GSZD 的化学成分。这些化学成分可缓解关节炎引起的炎症损伤,并调节肠道微生物群和生物体代谢。知母皂苷 B-II (TB-II) 是知母的主要生物活性成分,具有抗氧化和抗炎特性。有研究表明,TB-II可通过抑制 MAPK 和 NF-κB 通路抑制 IL-1β 刺激的炎症、氧化应激和 ECM 降解,从而成为治疗骨关节炎的新型治疗剂。升麻素通过抑制 NF-κB 信号通路促进体外 RANKL 诱导的破骨细胞生成,并防止体内假体周围骨溶解。此外,升麻素还可能通过抑制NF-κB/MAPK信号通路在银屑病样发病机制中的活性来抑制氧化应激和炎症反应,这可能为银屑病的治疗提供一种新的有效药物。此外,一些化学成分可调节肠道菌群和代谢。顺式-O-葡萄糖基升麻素(POG)是从中药防风中获得的提取物,具有抗炎、抗氧化和镇痛作用。值得注意的是,POG可以通过抑制促炎信号通路AKT、MAPK和NF-κB的敏化来调节肠道菌群的多样性和丰度,恢复肠道屏障的完整性,并对肠道发挥保护作用。抗抑郁药反式-2-苯基环丙胺(2-PCPA)可通过长期减少食物摄入量和短期增加活动量来减少肥胖,从而逆转饮食诱导的肥胖小鼠的肥胖迹象。化学成分的差异往往导致药理作用的差异。因此,我们通过检测肠道菌群和血清代谢物来研究 GSZD 的抗痛风机制。
在本研究中,我们在CON和MOD组之间在属水平上鉴定出 67 种差异肠道微生物群,其中 22 个属,包括乳酸杆菌属、Blautia、瘤胃球菌和Turicibacter,在 GSZD 干预后明显调整到正常水平。影响GA发病的重要因素之一是UA,其中2/3经肾小管分泌从尿道排出,其余1/3经肠道排出。肠上皮细胞中的UA转运蛋白负责将UA从血液转运到肠腔,在肠腔中直接排出或被肠道微生物群分解。因此,肠道菌群对UA代谢有重要影响。乳酸杆菌可参与黄嘌呤氧化酶的合成,而黄嘌呤氧化酶参与UA降解为尿素,也是嘌呤氧化代谢的主要酶。本研究也证实了乳酸杆菌与血清UA水平呈负相关。在炎症反应方面,Blautia是肠道炎症的重要驱动因素,GA大鼠Blautia的丰度较健康大鼠增加,GSZD干预后Blautia的相对丰度降低。此外,LPS作为革兰氏阴性菌的细胞壁成分,可引起内源性肠道感染,我们的研究结果显示GA大鼠的LPS水平明显增高,提示MOD肠道菌群结构中革兰氏阴性菌的比例明显增加。瘤胃球菌科可以改善肾功能,减少尿毒症毒素的产生,如硫酸吲哚酚和对甲酚硫酸盐。此外,肠道菌群瘤胃球菌可以产生丁酸,丁酸具有抗炎和其他潜在的生理功能。此外,Turicibacter菌株含有一系列对不同BA具有解偶联特性的胆汁盐水解酶,几种Turicibacter菌株可以调节宿主胆汁和脂质组成。如我们的研究所示,Turicibacter与UA、TNF-α以及IL-1β的表达呈负相关。GSZD给药导致Turicibacter水平升高,表明了一种独特的调节机制,不同于以前研究报告的机制。
此外,研究发现各种植物化学物质可以通过改善肠道屏障完整性和炎症来减少慢性健康问题。我们验证了肠道屏障连接蛋白 Occludin 和 Zo-1 的表达,表明 GSZD 可以增强肠道屏障功能。此外,基于 16S rRNA 的微生物群落分析表明,MOD 组中 Blautia 的丰度增加,而乳酸杆菌、瘤胃菌科和 Turicibacter 的丰度降低,而 GSZD 治疗可逆转这一现象,表明 GSZD 通过调节特定细菌和改善肠道屏障完整性有效缓解了 GA 和 UA 代谢。
此外,越来越多的研究表明,肠道菌群产生的代谢产物可以调节宿主的生理功能。本研究旨在为深入分析 GA 的发病机制和探索其预防和治疗策略提供科学依据。我们通过对样本中收集的血清代谢物进行高通量和多变量统计分析来筛选生物标志物。血清代谢组学分析显示,有27 种差异代谢物与 GA 的改善有关,主要包括脂肪酸、甘油磷脂、氨基酸和 BA,以及主要代谢途径,例如甘油磷脂代谢、胆汁分泌、丙氨酸、天冬氨酸和谷氨酸代谢以及精氨酸生物合成。代谢物一方面可以调节肾脏排泄功能,另一方面可以调节炎症反应。8-Iso-PGE2 是一种有效的肾血管收缩剂,可促进肾血管收缩并减少尿液中的尿酸排泄。蓖麻酸被认为是安全且耐受性良好的,具有强效的抗菌、抗炎、抗氧化和血管收缩特性,通过增加血管收缩活性和减少肾脏尿酸排泄,使血清尿酸水平升高。此外,戊酸是一种微生物衍生的炎症调节剂,其抗炎作用不仅是因为 Breg 和 CD4+ 效应 T 细胞中 IL-10 的产生强烈上调,而且还因为对致病性 Th17 细胞表型的强效抑制。亚精胺是通过鸟氨酸代谢分解合成的,在维持细胞活力、功能、增殖和分化方面起着重要作用。值得注意的是,有研究者研究证实亚精胺具有抑制细胞凋亡与炎症、增强神经营养因子表达的作用。GSZD不仅能下调8- Iso-PGE2及蓖麻酸的表达,减轻肾血管收缩,促进尿酸排泄,从而降低血清尿酸水平,还能增加戊酸和亚精胺的表达,抑制炎症反应,从而减轻疼痛症状。
随后,我们评估了肠道菌群与内源性代谢物的相关性。肠道菌群主要受脂质代谢物紊乱的复杂合成和代谢调节,这主要与与 GA 密切相关的高尿酸血症有关,例如 LysoPC(18:0)、LysoPC(17:0)、PC(18:0/0:0)、PC(20:4/0:0)和 PC(18:1/0:0)。PC 和 LysoPC 是线粒体膜、脂质转运和细胞过程所必需的重要内源性化合物。它们不仅维持胆碱平衡,还可以防止细胞和细胞器受到炎症和氧化应激的影响。当生物体处于炎症状态时,所有 LPC 都会聚集并产生不同的病理特征;它们是由磷脂酶 A2 从 PC 合成的。经过GSZD干预后,GA大鼠血清尿酸含量降低,提示该机制可能与PLA2活性降低有关。越来越多的研究表明肠-关节轴的存在,认为肠-关节轴和胃肠道微生物诱发的免疫炎症反应在关节相关疾病中起主要作用。既往研究表明,粪便菌群移植可以改善肠道菌群失衡。乳酸杆菌被认为是一种有益菌,可能通过调节促炎细胞因子和骨代谢相关标志物来影响骨骼健康。本研究显示乳酸杆菌与PC(20:4/0:0)表达呈正相关,提示通过调节菌群改善炎症反应可能是GSZD治疗GA的潜在机制。此外,据报道参与胆汁酸降解相关7-脱羟基化过程的 克里斯滕森菌科与内脏脂肪量呈负相关,被认为是瘦型表型的标志。在这项研究中,我们观察到克里斯滕森菌科_R-7 与 PC(16:0/0:0)呈负相关。GSZD 干预导致 PC(16:0/0:0)水平下降和克里斯滕森菌科_R-7 水平升高,这表明 GSZD 可能通过影响胆汁酸代谢来降低炎症因子。
最后,验证实验表明,GSZD 可以通过抑制参与嘌呤代谢的关键酶的活性来减少尿酸的产生。此外,GSZD 可以通过增加肠道屏障蛋白的表达来增强肠道屏障功能。最后通过检测肠道菌群产物LPS受体TLR4炎症通路的表达情况验证了GSZD的抗炎机制。这些结果表明GSZD可能通过调整肠道菌群的结构和功能来影响代谢过程,从而发挥其抗炎、抗痛风的药理作用。值得注意的是,虽然我们在16S rRNA的检测中没有包括DS,但肠屏障连接蛋白的检测提示DS组的Occludin和Zo-1的表达低于CON组。文献报道,DS还可以改变毛螺菌科、Blautia和大肠杆菌-志贺氏菌的丰度。因此,根据文献报道及本研究,我们推测DS可能由于非甾体抗炎药引起肠道细菌数量增加、肠道通透性增加而影响肠道菌群。
但本研究也存在一些局限性。一方面,GSZD通过干扰肠道微生物组成和血清代谢物减轻了GA动物的关节炎损伤。然而,其他药效学机制的参与需要进一步研究。另一方面,本研究检查了肠道和关节之间的病理变化和联系。然而,这些变化之间是否存在时间上的联系仍有待明确。在这方面值得进一步研究。
结论
我们建立了嘌呤诱导的GA大鼠,并用于研究GSZD的治疗作用。结合16S rRNA基因测序和血清代谢组学,我们探讨了GA的病理机制和GSZD对GA大鼠肠道菌群及其代谢谱的内在调控。我们的研究成功地表明GA与肠道菌群和血清代谢失调密切相关,而GSZD可以明显逆转这种失调。总体而言,GSZD 通过增加参与尿酸转运的菌群(如乳酸杆菌、瘤胃球菌科和 Turicibacter)的丰度,减少参与炎症反应的细菌(如Blautia)的丰度,以及调节甘油磷脂代谢、嘌呤代谢、胆汁分泌、丙氨酸、天冬氨酸和谷氨酸代谢以及精氨酸生物合成,有效缓解了 GA。我们还需要进一步的实验来验证不同肠道微生物群和代谢物的功能。我们的研究揭示了GSZD 改善 GA 的潜在机制,为 GSZD 作为未来治疗 GA 的潜在药物靶点提供了实验证据。
https://www.sciencedirect.com/science/article/pii/S0944711324004586?via%3Dihub#sec0014
中医药科研服务:
相关咨询,加微信:1278317307。
【福利时刻】科研服务(点击查看):、、、、、。咨询加微信:1278317307。
相关知识
FSHW | 胡椒碱调控高脂饮食诱导的肥胖大鼠肝脏生物钟基因和肠道菌群的昼夜节律
肠道菌群里藏着你的健康秘密
优化肠道菌群——对抗肌肉减少和骨质流失
农林1区:金樱子多糖靶向HFD大鼠氧化还原平衡和肠道界面减轻炎症性肥胖
Protein & Cell:肠道菌群及其代谢物在代谢性疾病中的作用
肠道菌群和健康——科普篇
了不起的肠道菌群
肠道菌群简介
动物肠道菌群的研究进展
犬猫肠道菌群特点与营养调控研究进展
网址: 1区-郑大一附院: 桂枝芍药知母汤调控肠道菌群和代谢改善大鼠痛风性关节炎 https://www.mcbbbk.com/newsview683151.html
| 上一篇: 【干苔菜】干苔菜图片介绍 |
下一篇: 中科院1区-吉林大学:代谢组学揭 |
推荐分享

- 1养玉米蛇的危害 28694
- 2狗交配为什么会锁住?从狗狗生 7180
- 3我的狗老公李淑敏33——如何 6236
- 4豆柴犬为什么不建议养?可爱的 4637
- 5南京宠物粮食薄荷饼宠物食品包 4563
- 6中国境内禁养的十大鸟种,你知 4429
- 7湖南隆飞尔动物药业有限公司宠 4259
- 8自制狗狗辅食:棉花面纱犬的美 4257
- 9家养水獭多少钱一只正常 4212
- 10广州哪里卖宠物猫狗的选择性多 4122






